题目内容
6.种子化学处理的主要方法是:用1%浓度的氯化钙溶液浸种,液种比为1:1,浸种5-6小时后播种,可以提高种子在干旱条件下的出芽率.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产氯化钙的主要流程如下: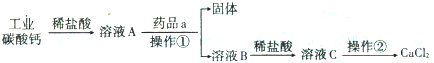
请回答下列问题
(1)加入药品a是Ca(OH)2,其目的是除去溶液中的少量Al3+、Fe3+.操作①中除用到烧杯、漏斗外,还需一种玻璃仪器,该仪器在此操作中的作用是引流.检验Fe(OH)3是否沉淀完全的实验操作是取溶液B中的少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全
(2)溶液B到溶液C的酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有将溶液中的少量Ca(OH)2转化为CaCl2;防止Ca2+在蒸发时水解;防止溶液吸收空气中CO2
(3)操作②的名称是蒸发浓缩、降温结晶,操作②需要用到的仪器有蒸发皿、玻璃棒、酒精灯、铁架台
(4)测定样品中Cl-含量的步骤是:a.称取0.5800g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c用0.05000mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL.上述测定过程中需用溶液润洗的仪器有滴定管;计算上述样品中CaCl2的质量分数为97.6%.
分析 (1)加入药品a,a为Ca(OH)2,Al3+、Fe3+生成沉淀而被除去;操作①为分离固体和溶液B的过滤,需要玻璃棒引流;Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③防止溶液吸收空气中CO2,
(3)操作2为蒸发浓缩、降温结晶,得到CaCl2;需要用到蒸发皿、玻璃棒、酒精灯、铁架台等仪器;
(4)①样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(CaCl2)=$\frac{1}{2}$n(AgCl)=$\frac{1}{2}$×0.05000mol•L-1×0.02039L×10=0.0050975mol,所以m(CaCl2)=0.0050975mol×111g/mol=0.5658g,则有:$\frac{0.5658g}{0.5800g}$×100%=97.6%.
解答 解:(1)加入药品a,a为Ca(OH)2,Al3+、Fe3+生成沉淀而被除去;操作①为分离固体和溶液B的过滤,需要玻璃棒引流;Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,
故答案为:Ca(OH)2;引流;取溶液B中的少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③防止溶液吸收空气中CO2,
故答案为:将溶液中的少量Ca(OH)2转化为CaCl2;防止Ca2+在蒸发时水解;防止溶液吸收空气中CO2;
(3)操作2为蒸发浓缩、降温结晶,得到CaCl2;需要用到蒸发皿、玻璃棒、酒精灯、铁架台等仪器;
故答案为:蒸发浓缩、降温结晶;蒸发皿、玻璃棒、酒精灯、铁架台;
(4)①样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(CaCl2)=$\frac{1}{2}$n(AgCl)=$\frac{1}{2}$×0.05000mol•L-1×0.02039L×10=0.0050975mol,所以m(CaCl2)=0.0050975mol×111g/mol=0.5658g,则有:$\frac{0.5658g}{0.5800g}$×100%=97.6%,
故答案为:97.6%.
点评 本题考查混合物中含量的测定,涉及实验的基本操作、实验仪器的选择、实验误差分析、混合物分离及含量测定的计算等,题目综合性较强,难度较大.

| A. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| B. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | SO3与CO32-互为等电子体,SO3是极性分子 |
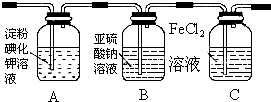
(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp2 | 正四面体形 | 正四面体形 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常见铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 常温下,pH=5的盐酸稀释1000倍后,溶液的pH=8 | |
| D. | 水的离子积随温度升高而增大,说明水的电离是吸热反应 |
| A. | HAt很稳定 | B. | At是有色固体 | ||
| C. | At易溶于有机溶剂 | D. | AgAt不溶于水 |
| A. | 非金属原子间不可能形成离子键 | B. | 只有不同的原子间才能形成共价键 | ||
| C. | 共价化合物中不可能含离子键 | D. | 离子化合物中可能含有共价键 |
 .
.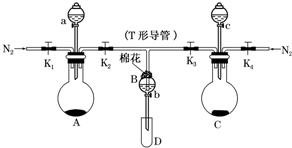 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).