题目内容
19.下列对应化学反应的离子方程式正确的是( )| A. | 向磷酸二氢铵溶液中加入足量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | FeSO4溶液在空气中放置变质:4Fe2++O2+2H2O═4Fe3++4OH- | |
| D. | 过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ |
分析 A.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液,磷酸二氢根离子、铵根离子均反应;
B.向氢氧化亚铁中加入足量的稀硝酸,发生氧化还原反应生成硝酸铁、NO和水;
C.FeSO4具有还原性,可被氧化生成铁离子,部分生成氢氧化铁;
D.过量SO2通入冷氨水中生成亚硫酸氢铵.
解答 解:A.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液的离子反应为H2PO4-+NH4++3OH-═NH3•H2O+2H2O+PO43-,故A错误;
B.向氢氧化亚铁中加入足量的稀硝酸,发生氧化还原反应生成硝酸铁、NO和水,反应的离子方程式为NO3-+3Fe(OH)2+10H+=3Fe3++NO↑+8H2O,故B错误;
C.FeSO4具有还原性,可被氧化生成铁离子,部分生成氢氧化铁,反应的离子方程式为12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+,故C错误;
D.过量SO2通入冷氨水中生成亚硫酸氢铵,离子方程式为SO2+NH3•H2O=HSO3-+NH4+,故D正确.
故选D.
点评 本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.某有机物的结构简式如图,关于该有机物性质的描述不正确的是( )
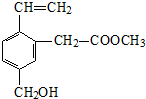
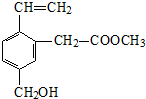
| A. | 能发生水解反应 | B. | 能发生酯化反应 | ||
| C. | 不易溶于水 | D. | 不能使酸性KMnO4溶液褪色 |
7.在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,若有8.7g MnO2参加反应,则被氧化的HCl的质量为( )
| A. | 14.6g | B. | 7.3g | C. | 3.65g | D. | 0.73g |
14.下列叙述正确的是( )
| A. | 碘晶体、碘蒸气是同素异形体 | |
| B. | 固态NaCl和HCl的熔化所克服的作用力不同 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 金刚石和石墨是同位素 |
5.金属在生产、生活中的应用十分广泛.
I.某研究性学习小组在探究钠、镁、铝金属性强弱的过程中设计了以下探究性实验方案,请填写下列空白:
实验用品:酒精灯、烧杯、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、2mol•L-1的硫酸
方案如下表:
(1)写出实验a的反应的离子方程式:2Na+2H2O═2Na++2OH-+H2↑
(2)你认为a、b两步实验中出现异常现象的可能原因是:
a.钠表面的煤油没有用滤纸吸干净;
b.镁条表面的氧化膜没有被除去.
(3)下列措施不能提高镁条与硫酸反应产生氢气的速率的是AE
A.改用18mol•L-1的硫酸 B.加入少量硫酸铜
C.改用镁粉 D.升高温度 E.增大压强
Ⅱ.根据以上实验知道,镁比铝活泼,甲同学突发奇想,想设计一个原电池,让镁不腐蚀而铝腐蚀.请你帮他实现这个设想,在下面方框中画出装置图1,并写出负极电极反应式.
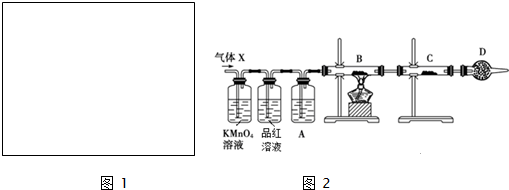
Ⅲ.工业上常用铝质容器盛装冷的浓硫酸,为研究铝质材料与热浓硫酸的反应,乙同学进行了以下探究活动:
(1)取铝片6.0g放入15.0mL浓硫酸中,加热,充分反应后收集到气体X.取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为50%.
(2)分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图2中夹持仪器省略).
①A中加入的试剂可能是浓硫酸
②若B中装氧化铜,C中装无水硫酸铜,则可以证明气体X中含有氢气的实验现象是B中固体由黑变红和C中固体由白变蓝.
I.某研究性学习小组在探究钠、镁、铝金属性强弱的过程中设计了以下探究性实验方案,请填写下列空白:
实验用品:酒精灯、烧杯、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、2mol•L-1的硫酸
方案如下表:
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a.取已切去表皮的一小块金属钠,放入盛有水的烧杯中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c.向两支盛有3mL 2mol•L-1硫酸的试管中加入大小相同的镁条和铝片 | 镁、铝与硫酸反应产生气泡剧烈程度不同 | 镁与硫酸反应产生气泡速率较快 |
(2)你认为a、b两步实验中出现异常现象的可能原因是:
a.钠表面的煤油没有用滤纸吸干净;
b.镁条表面的氧化膜没有被除去.
(3)下列措施不能提高镁条与硫酸反应产生氢气的速率的是AE
A.改用18mol•L-1的硫酸 B.加入少量硫酸铜
C.改用镁粉 D.升高温度 E.增大压强
Ⅱ.根据以上实验知道,镁比铝活泼,甲同学突发奇想,想设计一个原电池,让镁不腐蚀而铝腐蚀.请你帮他实现这个设想,在下面方框中画出装置图1,并写出负极电极反应式.

Ⅲ.工业上常用铝质容器盛装冷的浓硫酸,为研究铝质材料与热浓硫酸的反应,乙同学进行了以下探究活动:
(1)取铝片6.0g放入15.0mL浓硫酸中,加热,充分反应后收集到气体X.取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为50%.
(2)分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图2中夹持仪器省略).
①A中加入的试剂可能是浓硫酸
②若B中装氧化铜,C中装无水硫酸铜,则可以证明气体X中含有氢气的实验现象是B中固体由黑变红和C中固体由白变蓝.
9.下列关于有机物的说法不正确的是( )
| A. | 用饱和的Na2SO4溶液使鸡蛋清发生盐析,进而分离、提纯蛋白质 | |
| B. | 淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| C. | 苯酚与苯甲酸都能发生加成反应和取代反应 | |
| D. | 汽油和植物油都是碳氢化合物 |
10.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| D. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃 |
 .
.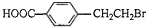 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.反应⑤的化学方程式是
+NaBr+H2O.反应⑤的化学方程式是 .
.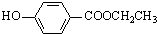 、
、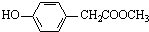 、还有4种.
、还有4种. X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: