题目内容
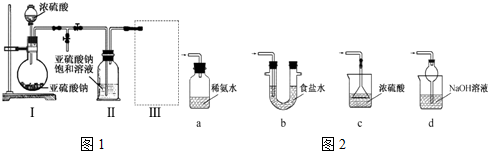
7.已知有机色质的发色官能团可以被氧化或发生加成反应生成无色物质.(1)为了探索比较SO2和Cl2的漂白原理,甲同学做了如下对比实验:
a.将干燥的SO2和干燥的Cl2分别通到干燥的品红试纸上,发现红色试纸均不褪色;
b.将SO2和Cl2分别通入品红溶液中,发现品红溶液均褪色;
c.加热b中漂白后的溶液,发现前者恢复红色,并产生刺激性气味的气体,后者无明显现象;
d.将SO2和Cl2分别持续通入紫色石蕊试液中,发现前者只变红,不褪色,后者先变红,后褪色.
请根据甲同学的实验事实,简要说明SO2与Cl2漂白原理的相同与不同之处.
相同之处:SO2和Cl2本身都没有漂白性,起漂白作用的分别是其与水反应后的产物H2SO3 和HClO
不同之处:①H2SO3只能与某些有机色质发生加合或化合反应,生成不稳定的无色物质,产物受热分解再放出SO2,是非氧化还原反应.HClO能与很多有机色质发生氧化还原反应,生成物较稳定.
(2)乙同学为了探索对比O3、H2O2和Cl2的漂白能力大小,将等体积等浓度的品红溶液与三种漂白剂呈喷雾状分别反应,至完全褪色时,发现消耗三种漂白剂的物质的量相同,但褪色时间O3最短,H2O2次之,Cl2最长.
②消耗三种漂白剂的物质的量相同的原因是:每摩尔物质得电子数相等.
③O3漂白速度较H2O2快的主要原因是氧化性O3>H2O2;
④Cl2漂白速度最慢的主要原因可能是Cl2与H2O反应生成HClO浓度较小.
(3)丙同学为了比较H2O2和NaClO的氧化性强弱,将两者混合,观察到产生大量无色无味气体.
⑤丙同学认为,发生反应的离子方程式为H2O2+ClO-═Cl-+H2O+O2↑,
由此确认NaClO的氧化性强于H2O2;丁同学认为产生气体也可能是H2O2分解的原因,建议丙同学进一步补充实验来确认.
⑥补充实验需要的试剂是AgNO3溶液和稀HNO3.
分析 ①次氯酸具有强氧化性,能够与有色物质发生氧化还原反应而导致有色物质褪色,且反应为非可逆的;
②O3、H2O2和Cl2与等体积等浓度的品红溶液分别反应,至完全褪色时,发现消耗三种漂白剂的物质的量相同,说明三种物质转移电子物质的量相等;
③反应速率快慢是由物质本身性质决定的,外界只是影响因素;
④物质的浓度越小,反应速率越小;
⑤产生的无色无味的气体是氧气,说明双氧水中氧元素被次氯酸根离子氧化成氧气,据此写出反应的离子方程式;
⑥若次氯酸根离子参与了反应,则反应后的溶液中一定含有氯离子,可用稀硝酸和硝酸银进行检验.
解答 解:①HClO检验强氧化性,能与很多有机色质发生氧化还原反应,且生成物较稳定,加热不会恢复,
故答案为:氧化还原;
②O3、H2O2和Cl2与等体积等浓度的品红溶液分别反应时,这三种物质具有强氧化性而使品红溶液褪色,至完全褪色时,发现消耗三种漂白剂的物质的量相同,说明三种物质转移电子物质的量相等,即每摩尔物质得电子数相等,
故答案为:得电子数;
③反应速率快慢是由物质本身性质决定的,外界只是影响因素,O3漂白速度比H2O2漂白速度快的主要原因是氧化性:O3>H2O2,
故答案为:氧化性O3>H2O2;
④物质的浓度越小,反应速率越小,氯气溶解性较小,1体积水只能溶解2体积氯气,所以氯气和水反应生成的HClO浓度较小,则Cl2漂白速度最慢,
故答案为:Cl2与H2O反应生成HClO浓度较小;
⑤生成的无色无味的气体应该为氧气,说明双氧水被次氯酸根离子氧化成氧气,反应的离子方程式为:H2O2+ClO-═Cl-+H2O+O2↑,
故答案为:H2O2+ClO-═Cl-+H2O+O2↑;
⑥可以检验反应后的溶液中是否含有氯离子进行判断次氯酸根离子是否发生反应,需要用到的试剂为AgNO3溶液和稀HNO3,
故答案为:AgNO3溶液和稀HNO3.
点评 本题考查性质实验方案的设计,题目难度的,设计漂白原理、化学反应速率影响因素、氧化性强弱判断、离子方程式书写、实验方案的设计与评价等知识,需要明确决定反应速率的是物质本身的性质,外界只是影响因素,弄清二氧化硫与这三种物质漂白原理的区别.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 红外光谱法 | B. | 色谱法 | C. | 质谱法 | D. | 核磁共振氢谱法 |
| A. | 碘晶体、碘蒸气是同素异形体 | |
| B. | 固态NaCl和HCl的熔化所克服的作用力不同 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 金刚石和石墨是同位素 |

下列说法正确的是( )
| A. | X的结构简式为:HOCH2CH=CHCH2OH | |
| B. | 反应③的转化条件a为:NaOH醇溶液,加热 | |
| C. | 1,3-丁二烯与等物质的量的Br2发生加成,所得产物可能有2种 | |
| D. | ①、②、③的反应类型依次为取代反应、加成反应、消去反应 |
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 分子间作用力越大,分子的热稳定性就越大 | |
| C. | 可能存在不含任何化学键的晶体 | |
| D. | 酸性氧化物形成的晶体一定分子晶体 |
| Q | R | ||
| T | W |
 .
.(2)元素的原子的得电子能力为:Q<W(填“>”或“<”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是具有漂白性的气体,反应的化学方程式为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.

 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: