5.下列说法不正确的是( )
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂 和蛋白质都是高分子化合物 | |
| C. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| D. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 |
4.下列做法不能体现低碳生活的是( )
| A. | 尽可能减少食品的加工过程 | B. | 注意节约用电 | ||
| C. | 尽量购买本地的、当季的食物 | D. | 大量使用作物秸秆为燃料 |
2.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeI2 | I2 | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | O2 | Mn2+ |
| A. | 表中①组的反应中氧化产物一定是I2 | |
| B. | 氧化性强弱的比较:KClO3>Cl2>Fe3+>I2 | |
| C. | 表中②组每生成1molCl2,转移1mol电子 | |
| D. | 表中③组其他反应物可以为浓盐酸 |
1.下列物质与足量铁反应,转移电子数最少的是( )
| A. | 1mol氯气 | B. | 1mol S | ||
| C. | 含1molHNO3的稀硝酸 | D. | 含1molCuSO4的硫酸铜溶液 |
17.下列实验操作或装置(略去部分加持仪器)正确的是( )
0 169729 169737 169743 169747 169753 169755 169759 169765 169767 169773 169779 169783 169785 169789 169795 169797 169803 169807 169809 169813 169815 169819 169821 169823 169824 169825 169827 169828 169829 169831 169833 169837 169839 169843 169845 169849 169855 169857 169863 169867 169869 169873 169879 169885 169887 169893 169897 169899 169905 169909 169915 169923 203614
| A. |  如图表示为配制一定物质的量浓度稀硫酸时的操作 | |
| B. |  如图表示为配制一定物质的量浓度的溶液定容时的操作 | |
| C. | 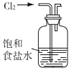 用如图所示装置吸收氯气中的氯化氢气体 | |
| D. | 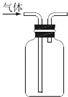 用图所示装置收集一氧化氮气体 |
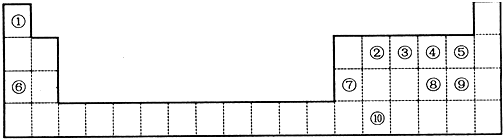
 ,元素②形成的最高价氧化物的结构式为O=C=O;
,元素②形成的最高价氧化物的结构式为O=C=O;
 按要求回答下列问题:
按要求回答下列问题: