题目内容
19.下列问题均涉及到化学学科重要的思想和观点,按要求回答下列问题:(1)量变和质变的观点:①锌与稀硫酸反应生成氢气,当硫酸浓度逐渐增大到一定程度时,可生成的气体是SO2(填化学式,下同);
②铜与稀硝酸反应生成一氧化氮,当硝酸浓度逐渐增大到一定程度时,可生成的气体是NO2;
③稀盐酸的还原性较弱,与二氧化锰不反应,浓盐酸的还原性增强,与二氧化锰在加热的条件下发生的反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)微粒观:①18g2H2O中所含质子的物质的量为9mol,所含的中子数为9NA;②Na2O2、Na2O中阳离子和阴离子个数比分别为2:1、2:1.
(3)守恒的思想:①由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1mol•L-1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为0.3mol•L-1;②mM+nH++O2═xM2++yH2O,则x值为2.③ClO2与Cl2均有强氧化性,在处理废水的过程中自身均被还原为Cl-,在处理相同量的废水时,所需要ClO2的物质的量是Cl2的0.4倍.
分析 (1)①浓硫酸具有强的氧化性,与金属反应生成二氧化硫;
②硝酸具有强的氧化性,浓硝酸还原产物为二氧化氮,稀硝酸还原产物为一氧化氮;
③浓盐酸具有强的还原性,能够与二氧化锰反应制取氯气,稀盐酸还原性较弱,与二氧化锰不反应;
(2)①1个2H2O中含有10个质子,10个中子;
②Na2O2、Na2O中阳离子都是钠离子,阴离子分别是过氧根离子和氧离子;
(3)①溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),根据溶液电荷守恒计算;
②由O原子守恒可确定y=2,进而确定n,结合电荷守恒、得失电子守恒确定x;
③ClO2和Cl2的还原产物都为Cl-,则反应中Cl元素化合价分别由+4价、0价降低到-1价,化合价分别变化5、1,以此解答.
解答 解:(1)①浓硫酸具有强的氧化性,与锌反应还原产物为SO2;
②浓硝酸还原产物为NO2,稀硝酸还原产物为一氧化氮;
③浓盐酸具有强的还原性,能够与二氧化锰反应制取氯气,方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;稀盐酸还原性较弱,与二氧化锰不反应;
故答案为:SO2;NO2;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)①1个2H2O中含有10个质子,10个中子,18g2H2O的物质的量为$\frac{18g}{20g/mol}$=0.9mol,含质子的物质的量为9mol,含的中子数为9 NA;
②Na2O2、Na2O中阳离子都是钠离子,阴离子分别是过氧根离子和氧离子,阳离子和阴离子个数比都是2:1;
故答案为:9mol;9 NA;2:1;2:1;
(3)①根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),而溶液中c(OH-)很小,可以忽略不计,
则有3c(Al3+)+c(K+)+c(H+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)-c(H+),
c(K+)═2×0.8mol/L-3×0.4mol/L-0.1mol/L=0.3mol/L;
②在反应mM+nH++O2=xM2++yH2O中,由O原子守恒可确定y=2,则n=4,由电荷守恒可知4×1=2×x,x=2;
③ClO2和Cl2的还原产物都为Cl-,则反应中Cl元素化合价分别由+4价、0价降低到-1价,化合价分别变化5、1,则ClO2的消毒效率是Cl2的$\frac{5}{2}$=2.5倍,在处理相同量的废水时,所需要ClO2的物质的量是Cl2的0.4倍;
故答案为:0.3mol•L-1;2;0.4.
点评 本题考查了硫酸、硝酸、盐酸的性质,化学方程式的书写、阿伏伽德罗常数的应用,守恒规律的应用,题目难度不大.

 字词句段篇系列答案
字词句段篇系列答案a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
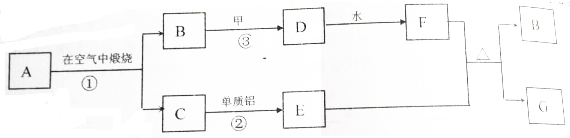
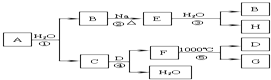 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )| A. | 反应①、③中H2O均是还原剂 | |
| B. | D与H溶液反应后所得溶液的溶质成分有三种可能 | |
| C. | 工业上常用C的悬浊液与Cl2反应制取漂白粉 | |
| D. | 电解F与盐酸反应后的溶液以制取单质A |
| A. | HCO3- | B. | SO32- | C. | CO32- | D. | CH3COO- |
| A. | 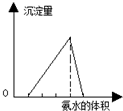 图可表示向酸化的AlCl3溶液中逐滴加入稀氨水,沉淀量与氨水体积的关系 | |
| B. |  图中可表示向澄清石灰水中通入二氧化碳气体,沉淀量与二氧化碳体积的关系 | |
| C. | 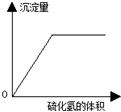 图中可表示向亚硫酸溶液中通入硫化氢,沉淀量与硫化氢气体的关系 | |
| D. | 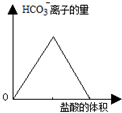 图中可表示向碳酸钠溶液中逐滴加入稀盐酸,HCO3-离子的量与盐酸体积的关系 |
| A. | 尽可能减少食品的加工过程 | B. | 注意节约用电 | ||
| C. | 尽量购买本地的、当季的食物 | D. | 大量使用作物秸秆为燃料 |
| A. | 0.1mol•L-1 FeSO4溶液中:K+,NH4+,MnO4-,ClO- | |
| B. | 澄清透明的溶液中:Fe3+,Mg2+,SO42-,Br- | |
| C. | c(H+)=$\sqrt{{K}_{W}}$的溶液中:K+,Al3+,Cl-,SO42- | |
| D. | 使酚酞变红色的溶液:Na+,NH2CH2COOH,I-,Ba2+ |
| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 向海水中加入净水剂明矾可以使海水淡化 | |
| C. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |