题目内容
18.化学学习中要注重对过程的分析,按要求回答下列问题:(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式Ba2++SO42-═BaSO4↓.
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为NH4++OH-═NH3↑+H2O.
(3)过氧化钠与干燥的二氧化碳不反应,与湿润的二氧化碳反应生成氧气,则该过程的两个反应方程式分别为2Na2O2+2H2O═4NaOH+O2↑、2NaOH+CO2═Na2CO3+H2O.
(4)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是H+、HClO.
(5)向含1molFeBr2的溶液中通入11.2L(标准状况下)氯气,才能将Fe2+全部转化为Fe3+.
(6)足量的铜与一定体积的浓硫酸反应,反应后溶液中所含的溶质有CuSO4、H2SO4(填化学式).
分析 (1)加入Ba(OH)2溶液至中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,以此书写离子方程式;至中性时溶液中溶质只有Na2SO4,加入Ba(OH)2溶液生成BaSO4沉淀;
(2)钠与水反应生成氢氧化钠和氢气,氢氧化钠与铵根离子反应生成氨气和水;
(3)过氧化钠先与水反应生成氢氧化钠和氧气,然后氢氧化钠与二氧化碳反应生成碳酸钠和水;
(4)氯气与水反应生成盐酸和次氯酸,HCl具有酸性,HClO具有漂白性;
(5)亚铁离子的还原性大于溴离子,所以通入少量氯气后,亚铁离子优先反应,据此进行计算;
(6)稀硫酸不与铜反应,所以随着反应的进行,浓硫酸变成稀硫酸,反应会停止,所以反应后溶质为硫酸铜和硫酸.
解答 解:(1)NaHSO4是二元强酸的酸式盐,可以理解为全部电离.当反应后溶液呈中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,则离子反应方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
此时溶液中溶质只有Na2SO4,加入Ba(OH)2的离子反应方程式为:Ba2++SO42-=BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;Ba2++SO42-═BaSO4↓;
(2)第一步反应为钠与水反应生成氢氧化钠和氢气,第二步反应为铵根离子与氢氧根离子反应生成氨气,反应的离子方程式为:NH4++OH-═NH3↑+H2O
故答案为:NH4++OH-═NH3↑+H2O;
(3)过氧化钠与水反应生成氢氧化钠和氧气:2Na2O2+2H2O═4NaOH+O2↑,生成的氢氧化钠与二氧化碳反应生成碳酸钠和水:2NaOH+CO2═Na2CO3+H2O,
故答案为:2Na2O2+2H2O═4NaOH+O2↑; 2NaOH+CO2═Na2CO3+H2O;
(4)氯气与水反应生成盐酸和次氯酸,HCl具有酸性,能够使紫色石蕊溶液变红,HClO具有强氧化性,能够使溶液褪色,所以使溶液变红和褪色的微粒分别是H+、HClO,
故答案为:H+;HClO;
(5)亚铁离子的还原性大于溴离子,所以亚铁离子优先反应,1molFeBr2的溶液含有1mol亚铁离子,根据反应2Fe2++Cl2=2Fe3++2Cl-可知,氧化1mol亚铁离子需要消耗0.5mol氯气,标况下0.5mol氯气的体积为:22.4L/mol×0.5mol=11.2L,
故答案为:11.2;
(6)铜只与浓硫酸反应,浓硫酸变成稀硫酸后反应停止,所以反应后溶质为生成的CuSO4和剩余的H2SO4,
故答案为:CuSO4、H2SO4.
点评 本题考查离子方程式的书写,题目难度中等,注意根据物质的量判断反应的程度并书写相关离子方程式,注意与量有关的离子方程式的书写方法.

| A. | Zn 具有导电性,用作锌锰干电池的负极材料 | |
| B. | 锌的金属活泼性比铁的强,可在海轮外壳上装若干锌板以减缓其腐蚀 | |
| C. | NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨忪剂 | |
| D. | 常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸 |
| A. | HCl、N2、NH3 | B. | Cl2、CO2、O2 | C. | NO、O2、N2 | D. | SO2、CO、H2S |
 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2═SOCl2+SO2,下列有关说法正确的是( )
| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
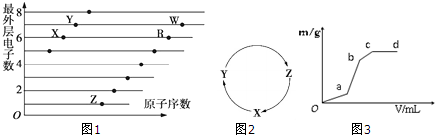


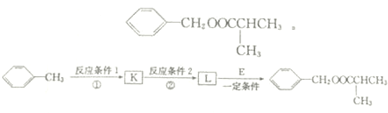
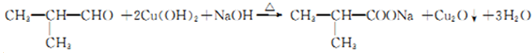 .
. .
. 反应②所选用的试剂为氢氧化钠溶液,L的结构简式为
反应②所选用的试剂为氢氧化钠溶液,L的结构简式为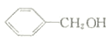 .
.