题目内容
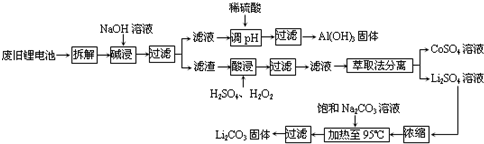
3.通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力.(1)如图1是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.按要求回答问题:
①Y元素在元素周期表中的位置为第二周期第VIIA族.
②②气态氢化物的稳定性:X<(填“>”“<”)Y.
③这五种元素形成的简单离子中,离子半径最大的是S2-(填离子符号).
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为NaH+H2O=NaOH+H2↑.
(2)X、Y、Z三种物质有以下转化关系(图2):
①如果三种物质中均含Mg元素,且X为镁单质,则Y、Z可能是MgO、MgCl2(填化学式,只填一种物质即可,下同);
②如果三种物质中均含Cl元素,且X为Cl2,则Y、Z可能是HCl、NaCl;
③如果三种物质中均含Si元素,且X为SiO2,则Y、Z可能是Na2SiO3、、H2SiO3.
(3)向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,生成沉淀质量m与Ba(OH)2体积V之间的关系(图3),则oa段生成的沉淀为BaSO4(填化学式,下同),ab段生成的沉淀为BaSO4和Mg(OH)2;bc段生成的沉淀为Mg(OH)2.
分析 (1)短周期元素中,X、R的最外层电子数均为6,X的原子序数小,则X为O,R为S,同理可知Y为F,W为Cl,而Z为第三周期元素,最外层电子数为1,即Z为Na;
①Y为F,原子结构中有3个电子层,最外层电子数为7;
②非金属性越强,氢化物越稳定;
③电子层越多,离子半径越大,相同电子排布的离子原子序数大的离子半径小;
④NaH与水反应生成NaOH和氢气;
(2)根据 X、Y、Z三种物质的转化关系,X反应生成Y,Y反应生成Z,Z反应再生成X,
①如果三种物质中均含Mg元素,且X为镁单质,则Y可能为MgO、,Z可能为MgCl2;
②如果三种物质中均含Cl元素,且X为Cl2,则Y可能是HCl,Z可能是NaCl;
③如果三种物质中均含Si元素,且X为SiO2,则Y可能是Na2SiO3、Z可能是H2SiO3;
(3)向用盐酸酸化的MgSO4溶液中加入Ba(OH)2后,首先是Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-跟盐酸的H+发生中和反应生成水;由于HCl的存在,OH-不能与Mg2+产生沉淀Mg(OH)2,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀,当MgSO4溶液全部反应后,再加入Ba(OH)2溶液不再产生沉淀.
解答 解:(1)短周期元素中,X、R的最外层电子数均为6,X的原子序数小,则X为O,R为S,同理可知Y为F,W为Cl,而Z为第三周期元素,最外层电子数为1,即Z为Na;
①Y为F,原子结构中有3个电子层,最外层电子数为7,则位于第二周期第ⅤⅡA族,故答案为:第二周期第ⅤⅡA族;
②非金属性Y>X,氢化物的稳定性为X<Y,故答案为:<;
③电子层越多,离子半径越大,相同电子排布的离子原子序数大的离子半径小,这五种元素形成的简单离子中,离子半径最大的是S2-,故答案为:S2-;
④NaH与水反应生成NaOH和氢气,反应为NaH+H2O=NaOH+H2↑,故答案为:NaH+H2O=NaOH+H2↑;
(2)根据 X、Y、Z三种物质的转化关系,X反应生成Y,Y反应生成Z,Z反应再生成X,
①如果三种物质中均含Mg元素,且X为镁单质,则Y可能为MgO、,Z可能为MgCl2;
②如果三种物质中均含Cl元素,且X为Cl2,则Y可能是HCl,Z可能是NaCl;
③如果三种物质中均含Si元素,且X为SiO2,则Y可能是Na2SiO3、Z可能是H2SiO3;
故答案为:①MgO、MgCl2;②HCl、NaCl;③Na2SiO3、H2SiO3;
(3)向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液后,0a段表示产生的沉淀只是BaSO4,由于HCl的存在,OH-不能与Mg2+产生沉淀Mg(OH)2;ab段表示的沉淀有BaSO4和Mg(OH)2,是因为H+完全反应后,不仅Ba2+与溶液中的SO42-反应生成BaSO4沉淀,而且OH-与Mg2+反应产生沉淀Mg(OH)2,所以沉淀多;bc段表示沉淀有Mg(OH)2沉淀,因为溶液中SO42-反应完,只有Mg2+与OH-生成Mg(OH)2沉淀;cd段没有沉淀,因为溶液中MgSO4溶液已完全反应完,不能与加入的Ba(OH)2反应,Ba(OH)2是过量的,
故答案为:BaSO4;BaSO4和Mg(OH)2;Mg(OH)2.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,推断元素、氧化还原反应及离子反应的先后顺序为解答的关键,侧重分析与推断及元素化合物知识的综合考查,题目难度中等.

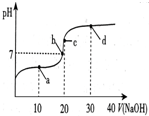 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| A. | 航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,具有耐高温防寒等性能 | |
| B. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 明矾可用于自来水的净化,氯气可用于自来水的杀菌消毒 |
| A. | 蒸发 | B. | 蒸馏 | C. | 萃取 | D. | 过滤 |
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),前者放出的热量多 | |
| D. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
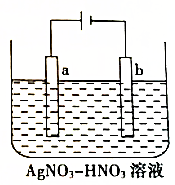 如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.