6.对于淀粉和纤维素两物质,下列说法不正确的是( )
| A. | 都可用(C6H10O5)n表示,淀粉有甜味,而纤维素没有 | |
| B. | 二者含C、H、O三种元素的质量分数相同,但不是同分异构体 | |
| C. | 它们都属于糖类,且都是高分子化合物 | |
| D. | 两者在工业上都可以用作生产葡萄糖的原料 |
5.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 二氧化氮被木炭吸附 | ||
| C. | HCl气体溶于水 | D. | 酒精溶于水 |
3.除了酸以外,某些盐也能溶解沉淀.利用下表三种试剂进行实验,相关分析不正确的是( )
| 编号 | ① | ② | ③ |
| 分散质 | Mg(OH)2 | HCl | NH4Cl |
| 备注 | 悬浊液 | 1mol/L | 1mol/L |
| A. | 向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动 | |
| B. | 向①中加入酚酞显红色,说明物质的“不溶性”是相对的 | |
| C. | 向①中加入③,沉淀溶解,说明Mg(OH)2比NH3•H2O更难电离 | |
| D. | ①③混合后发生反应:Mg(OH)2(s)+2NH4+?Mg2++2NH3•H2O |
2.下列解释事实的方程式不正确的是( )
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
1.25℃时,甲溶液的pH是10,乙溶液的pH是11,甲溶液与乙溶液中c(H+)之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:10 | D. | 10:1 |
20.在生活、生产中为增大化学反应速率而采取的措施合理的是( )
| A. | 食物放在冰箱里 | B. | 在糕点包装内放置小包除氧剂 | ||
| C. | 燃煤发电时用煤粉代替煤块 | D. | 塑料制品中添加抑制剂 |
19.下列物质中属于弱电解质的是( )
| A. | Na2O2 | B. | Al(OH)3 | C. | H2SO4 | D. | BaSO4 |
18.分别在250℃和T℃下将1mol CO和2molH2充入一容积为1L的密闭容器中发生反应:CO(g)+2H2(g)?CH2OH(g)△H=a kJ/mol,结合如图分析下列说法中正确的是( )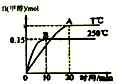

| A. | 混合气体的密度不变能说明该反应到达平衡状态 | |
| B. | a>0 | |
| C. | 其他条件不变,若减小容积体积,CO质量分数增大 | |
| D. | 平衡常数K:T℃时大于250℃ |
17.海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间,某地海水中主要离子的含量如下表:
(1)海水显弱碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.该海水中Ca2+的物质的量浓度为5×10-3 mol•L-1.
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
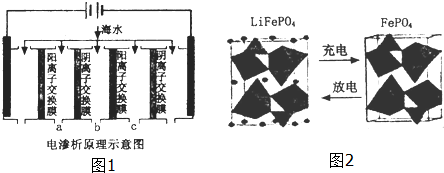
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
0 169723 169731 169737 169741 169747 169749 169753 169759 169761 169767 169773 169777 169779 169783 169789 169791 169797 169801 169803 169807 169809 169813 169815 169817 169818 169819 169821 169822 169823 169825 169827 169831 169833 169837 169839 169843 169849 169851 169857 169861 169863 169867 169873 169879 169881 169887 169891 169893 169899 169903 169909 169917 203614
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
