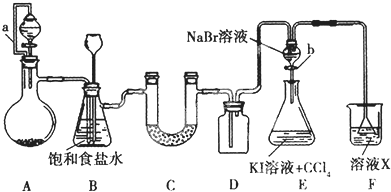
题目内容
17.海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间,某地海水中主要离子的含量如下表:| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
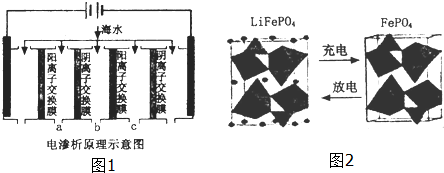
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
分析 (1)分析海水中存在的离子性质判断,碳酸氢根离子是弱酸阴离子水解显碱性,结合海水中钙离子含量为200mg/L,利用物质的量浓度概念计算得到;
(2)①依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阴极上是阳离子得到电子发生还原反应;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;
(3)在原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据得失电子确定正负极,根据反应物、生成物书写电极反应式.
解答 解:(1)海水中存在的离子性质判断,碳酸氢根离子是弱酸阴离子水解显碱性,离子方程式为:HCO3-+H2O?H2CO3+OH-,结合海水中钙离子含量为200mg/L,物质的量浓度=$\frac{\frac{200×10{\;}^{-3}g}{40g/mol}}{1L}$=5×10-3 mol/L;
故答案为:HCO3-+H2O?H2CO3+OH-,5×10-3 ;
(2)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,
故答案为:b;
(3)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:正;FePO4+e-+Li+=LiFePO4.
点评 本题考查了化学电源新型电池,电解池原理分析判断,海水淡化的电渗析原理的分析判断,题目难度中等,掌握原理即可解答.

 名校课堂系列答案
名校课堂系列答案| A. | 用无水硫酸铜检验乙醇中是否含水 | |
| B. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| C. | 用蒸馏的方法可以分离醋酸与乙醇的混合物 | |
| D. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 |
| A. | 用锌粉代替锌粒 | B. | 改用热的2 mol/L硫酸溶液 | ||
| C. | 改用3 mol/L硫酸溶液 | D. | 向该硫酸溶液中加入等体积的水 |
| A. | AgI,AgBr,AgCl | B. | AgCl,AgI,AgBr | C. | AgBr,AgI,AgCl | D. | AgCl,AgBr,AgI |
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
为鉴别其中含有的离子,进行如下实验:
①用玻璃棒蘸取原溶液滴在pH试纸上,试纸显红色;
②另取少量原溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,生成白色沉淀.
下列关于原溶液的说法正确的是( )
| A. | 原溶液中一定不存在Ba2+和HCO3- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定存在SO42-和Cl- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
| A. | 上述测定不能达到实验目的 | B. | 剩余的7.48g金属为铜 | ||
| C. | 共生成NO气体 0.04mol | D. | 该合金中铜的质量分数为69.2% |