题目内容
18.分别在250℃和T℃下将1mol CO和2molH2充入一容积为1L的密闭容器中发生反应:CO(g)+2H2(g)?CH2OH(g)△H=a kJ/mol,结合如图分析下列说法中正确的是( )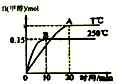
| A. | 混合气体的密度不变能说明该反应到达平衡状态 | |
| B. | a>0 | |
| C. | 其他条件不变,若减小容积体积,CO质量分数增大 | |
| D. | 平衡常数K:T℃时大于250℃ |
分析 依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0;
A.该反应在恒容条件下进行,反应前后气体的质量保持不变,故在反应过程中气体密度始终不变;
B.正反应为放热反应,△H<0;
C.其他条件不变,若减小容积体积,压强增大,平衡正移;
D.△H<0,升高温度,平衡逆向移动,K减小
解答 解:依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0;
A.该反应在恒容条件下进行,反应前后气体的质量保持不变,故在反应过程中气体密度始终不变,所以混合气体的密度不变能说明该反应到达平衡状,故A错误;
B.由以上分析可知△H<0,即a<0,故B错误;
C.其他条件不变,若减小容积体积,压强增大,平衡正移,CO的物质的量减少,CO物质的量分数减小,所以CO体积分数减小,故C错误;
D.由以上分析可知△H<0,即a<0,即升高温度,平衡逆向移动,K减小,所以平衡常数K:T℃时大于250℃,故D正确;
故选D.
点评 本题考查物质的量随时间的变化图象,由明确图象中量的变化来分析反应速率、转化率、影响平衡的移动因素等,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
8.戊二醛(OHCCH2CH2CH2CHO)在pH为7.5~8.5时,杀菌消毒的作用最强,可杀灭细菌的繁殖体和芽孢、真菌、病毒,其作用较甲醛强2~10倍.下列有关说法正确的是( )
| A. | 戊二醛的消毒原理与漂白粉、臭氧等消毒剂相同 | |
| B. | 1 mol 戊二醛分子可被1 mol Cu(OH)2完全氧化 | |
| C. | CH3CH═CHCH2COOH与戊二醛互为同分异构体 | |
| D. | 10g戊二醛完全燃烧需消耗0.6 mol O2 |
9.与500mL1mol/LNaNO3中的NO3-浓度相等的是( )
| A. | 100mL 2mol/L NH4NO3溶液 | B. | 40mL 0.5mol/L Ca(NO3)2溶液 | ||
| C. | 50mL 1.5mol/L Al(NO3)3溶液 | D. | 150mL 1mol/L Mg(NO3)2溶液 |
3.除了酸以外,某些盐也能溶解沉淀.利用下表三种试剂进行实验,相关分析不正确的是( )
| 编号 | ① | ② | ③ |
| 分散质 | Mg(OH)2 | HCl | NH4Cl |
| 备注 | 悬浊液 | 1mol/L | 1mol/L |
| A. | 向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动 | |
| B. | 向①中加入酚酞显红色,说明物质的“不溶性”是相对的 | |
| C. | 向①中加入③,沉淀溶解,说明Mg(OH)2比NH3•H2O更难电离 | |
| D. | ①③混合后发生反应:Mg(OH)2(s)+2NH4+?Mg2++2NH3•H2O |
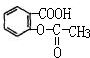 它的化学式为C9H8O4,其分子中含有羧基和酯基两种官能团(写官能团的名称),下列反应能发生的是(填字母):A、B、D(选项:A取代反应、B水解反应、C消去反应、D加成反应),该化合物1mol最多能跟3molNaOH反应.
它的化学式为C9H8O4,其分子中含有羧基和酯基两种官能团(写官能团的名称),下列反应能发生的是(填字母):A、B、D(选项:A取代反应、B水解反应、C消去反应、D加成反应),该化合物1mol最多能跟3molNaOH反应.
 .
.
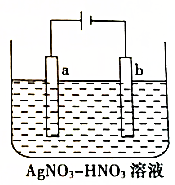 如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.