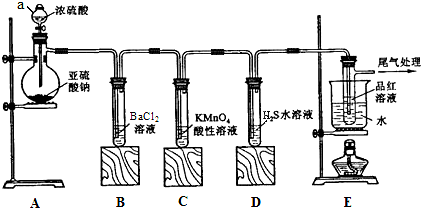
题目内容
1.25℃时,甲溶液的pH是10,乙溶液的pH是11,甲溶液与乙溶液中c(H+)之比是( )| A. | 1:2 | B. | 2:1 | C. | 1:10 | D. | 10:1 |
分析 根据pH=-lgc(H+),结合甲溶液的pH=10,乙溶液的pH=11,计算甲溶液与乙溶液的c(H+)之比.
解答 解:pH=-lgc(H+),常温下,甲溶液的pH=10,溶液中c(H+)=1×10-10mol/L,乙溶液的pH=11,溶液中c(H+)=1×10-11mol/L,甲溶液与乙溶液的c(H+)之比为1×10-10mol/L:1×10-11mol/L=10:1,
故选D.
点评 本题考查PH的简单计算,掌握PH和氢离子间的关系是解答该题的关键,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
9.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
16.电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是( )
| A. | 锂离子电池已成为笔记本电脑、移动电话等低功耗电器的主流电源 | |
| B. | 氢氧燃料电池可将化学反应的热能直接转变为电能 | |
| C. | 铅蓄电池放电时铅在负极被氧化成二氧化铅 | |
| D. | 锌锰干电池工作一段时间后碳棒变细 |
6.对于淀粉和纤维素两物质,下列说法不正确的是( )
| A. | 都可用(C6H10O5)n表示,淀粉有甜味,而纤维素没有 | |
| B. | 二者含C、H、O三种元素的质量分数相同,但不是同分异构体 | |
| C. | 它们都属于糖类,且都是高分子化合物 | |
| D. | 两者在工业上都可以用作生产葡萄糖的原料 |
13.化学与科技、社会、环境密切相关,下列说法不符合科学原理的是( )
| A. | 高纯硅制作光导纤维 | B. | 石墨制作火箭发动机喷管 | ||
| C. | 地沟油水解制取肥皂 | D. | 有机垃圾发酵生产沼气 |
10.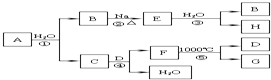 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )| A. | 反应①、③中H2O均是还原剂 | |
| B. | D与H溶液反应后所得溶液的溶质成分有三种可能 | |
| C. | 工业上常用C的悬浊液与Cl2反应制取漂白粉 | |
| D. | 电解F与盐酸反应后的溶液以制取单质A |
11.常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A. | 0.1mol•L-1 FeSO4溶液中:K+,NH4+,MnO4-,ClO- | |
| B. | 澄清透明的溶液中:Fe3+,Mg2+,SO42-,Br- | |
| C. | c(H+)=$\sqrt{{K}_{W}}$的溶液中:K+,Al3+,Cl-,SO42- | |
| D. | 使酚酞变红色的溶液:Na+,NH2CH2COOH,I-,Ba2+ |
 :
: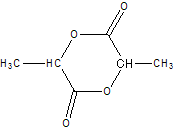 、
、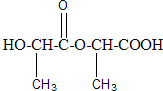 .
.