题目内容
2.下列解释事实的方程式不正确的是( )| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
分析 A.一水合氨为弱电解质,不能完全电离;
B.在氯化铁催化作用下,过氧化氢分解生成氧气和水;
C.氯化铜为电解质,可电离;
D.CuS溶解度比氢氧化铜小,可生成CuS.
解答 解:A.测得0.1mol/L的氨水的pH为11,说明一水合氨为弱电解质,不能完全电离,电离方程式为NH3•H2O?NH4++OH-,故A正确;
B.在氯化铁催化作用下,过氧化氢分解生成氧气和水,应为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,故B错误;
C.氯化铜为电解质,可电离,溶液导电,故C正确;
D.CuS溶解度比氢氧化铜小,可生成CuS,发生Cu(OH)2 (s)+S2-?CuS (s)+2 OH-,故D正确.
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重弱电解质的电离、难溶电解质的溶解平衡等应的考查,题目难度不大.

练习册系列答案
相关题目
12.据最新报道,放射性同位素钬${\;}_{67}^{166}$Ho可有效地治疗肝癌.该同位素原子内中子数为( )
| A. | 99 | B. | 67 | C. | 32 | D. | 166 |
17.海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间,某地海水中主要离子的含量如下表:
(1)海水显弱碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.该海水中Ca2+的物质的量浓度为5×10-3 mol•L-1.
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
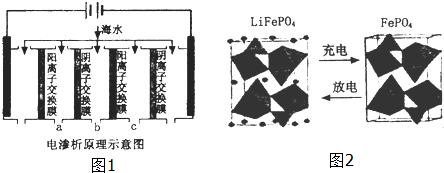
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
7.关于吸热反应的说法正确的是( )
| A. | C02与CaO化合是放热反应,则CaC03分解是吸热反应 | |
| B. | 只有分解反应才是吸热反应 | |
| C. | 使用催化剂的反应是吸热反应 | |
| D. | 凡需加热的反应一定是吸热反应 |
14.下列化学表述正确的是( )
| A. | 氯化钠的晶体模型: | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
11.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温下,10L pH=1的硫酸溶液中含有的H+数为NA | |
| B. | 将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| D. | 1molAl3+含有的核外电子数为3NA |