2.某结晶水合物的化学式为R•nH2O,其相对分子质量为M.25℃时,ag该晶体能够溶于bg水中形成VmL溶液,下列关系中不正确的是( )
| A. | 该溶液中溶质的质量分数为ω=$\frac{100a(M-18n)}{a+b}$% | |
| B. | 该溶液的物质的量浓度为c=$\frac{1000a}{MV}$mol•L-1 | |
| C. | 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=($\frac{18na}{M}+b$):(a-$\frac{18na}{M}$) | |
| D. | 该溶液的密度为ρ=$\frac{1000(a+b)}{V}$g•L-1 |
1.已知酸性H2SO3>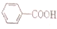 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将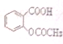 转变为
转变为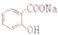 ,可行的方法是( )
,可行的方法是( )
 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 加稀硫酸共热后,再加入足量NaOH溶液 | |
| C. | 加热该物质溶液,再通入足量的SO2 | |
| D. | 与稀硫酸共热后,加入足量的Na2CO3 |
19.电动车电池是一种锂离子电池.根据锂离子电池所用电解质材料不同,锂离子电池可以分为液态锂离子电池(简称为LIB)和聚合物锂离子电池(简称为LIP)两大类,聚合物锂离子电池总反应:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6,以下说法正确的是( )
| A. | 充电时,阴极反应式:LiCo2-xe-═Li1-xCoO2+xLi+ | |
| B. | 充电时,阳极反应式:6C+xLi++xe-═LixC6 | |
| C. | 充电时,电池的负极与电源的负极相连 | |
| D. | 放电时,Li+向负极移动 |
17. 2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:
2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:
(1)现已知下列反应:
①N2(g)+O2(g)═2NO(g)△H1=+180.8kJ/mol
②2C(s)+O2(g)═2CO(g)△H2=-221.2kJ/mol
③C(s)+O2(g)═CO2(g)△H3=-393.6kJ/mol
则△H与△H1、△H2、△H3之间的关系是:△H=2△H3-△H2-△H1,反应2NO(g)+2CO(g)═N2(g)+2CO2(g)属于放热反应.(填“吸热”或“放热”)
(2)为了测定在某种催化剂作用下的反应速率,某研究性学习小组在技术人员的指导下,收集一定量的汽车尾气,并将其转入催化反应器,在某温度下,用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
前2s内的平均反应速率v(CO)=8.5×10-4mol/(L.s);
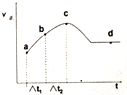
(3)该小组还研究了向绝热、恒容的密闭容器中通入CO、NO使其在一定条件下发生反应,测得正反应的速率如下图所示,t1=△t2,则:
①NO的转化率在a~b段和b~c段的转化率关系为:αa-b<αb-c(填“>”、“<”或“=”).
②a、b、c、d四个点,哪个点表示化学反应达到平衡状态d;
③解释c点前后速率变化的原因这是一个放热反应,一开始反应放出热量使体系的温度升高,此时温度是影响反应速率的主要因素,随温度的升高,反应速率加快,所以一开始时反应速率在增大;c点后随反应的进行反应物的浓度减少,反应物浓度的变化是影响化学反应速率的主要因素,所以c点后反应速率减少..
 2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:
2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:(1)现已知下列反应:
①N2(g)+O2(g)═2NO(g)△H1=+180.8kJ/mol
②2C(s)+O2(g)═2CO(g)△H2=-221.2kJ/mol
③C(s)+O2(g)═CO2(g)△H3=-393.6kJ/mol
则△H与△H1、△H2、△H3之间的关系是:△H=2△H3-△H2-△H1,反应2NO(g)+2CO(g)═N2(g)+2CO2(g)属于放热反应.(填“吸热”或“放热”)
(2)为了测定在某种催化剂作用下的反应速率,某研究性学习小组在技术人员的指导下,收集一定量的汽车尾气,并将其转入催化反应器,在某温度下,用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s | 0 | 2 | 3 | 4 |
| C(NO0(×10-4mol•L-1) | 20.0 | 3.00 | 2.00 | 2.00 |
| C(CO)(×10-3mol•L-1) | 2.70 |
(3)该小组还研究了向绝热、恒容的密闭容器中通入CO、NO使其在一定条件下发生反应,测得正反应的速率如下图所示,t1=△t2,则:
①NO的转化率在a~b段和b~c段的转化率关系为:αa-b<αb-c(填“>”、“<”或“=”).
②a、b、c、d四个点,哪个点表示化学反应达到平衡状态d;
③解释c点前后速率变化的原因这是一个放热反应,一开始反应放出热量使体系的温度升高,此时温度是影响反应速率的主要因素,随温度的升高,反应速率加快,所以一开始时反应速率在增大;c点后随反应的进行反应物的浓度减少,反应物浓度的变化是影响化学反应速率的主要因素,所以c点后反应速率减少..
15.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述不正确的是( )
| A. | 锌锰干电池工作一段时间后锌皮变薄 | |
| B. | 铅蓄电池工作一段时间后两极板质量都增加 | |
| C. | 氢氧燃料电池将电能直接转变为化学能 | |
| D. | 银锌纽扣电池工作一段时间后有银单质生成 |
14.某烷烃的相对分子质量是72,其同分异构体的数目是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
13.下列对一些实验事实和理论解释正确的是( )
0 169301 169309 169315 169319 169325 169327 169331 169337 169339 169345 169351 169355 169357 169361 169367 169369 169375 169379 169381 169385 169387 169391 169393 169395 169396 169397 169399 169400 169401 169403 169405 169409 169411 169415 169417 169421 169427 169429 169435 169439 169441 169445 169451 169457 169459 169465 169469 169471 169477 169481 169487 169495 203614
| 选项 | 实验事实 | 理论解释 |
| A | 稀硫酸能导电 | H2SO4为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
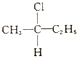 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域.
2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域. 、
、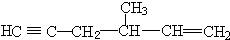 .
. ②
②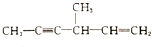 ③
③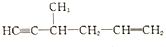
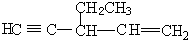 .
.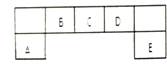 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题: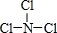 .
.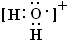 .该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.