题目内容
13.下列对一些实验事实和理论解释正确的是( )| 选项 | 实验事实 | 理论解释 |
| A | 稀硫酸能导电 | H2SO4为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫酸分子中只存在共价键;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.熔融状态下能导电的化合物含有离子键;
D.元素的非金属性强弱与其氢化物的熔沸点高低无关.
解答 解:A.硫酸中只含共价键,为共价化合物,但硫酸在水溶液中能电离出阴阳离子而使稀硫酸溶液导电,故A错误;
B.氢化物的水溶液酸性强弱与非极性强弱无关,与化学键的强弱有关,故B错误;
C.熔融状态下能导电的化合物中含有离子键,K3C60在熔融状态下能够导电说明为离子化合物,故C正确;
D.氢化物的熔沸点与相对分子质量、氢键有关,与非金属性强弱无关,故D错误;
故选C.
点评 本题考查化合物类型判断及非金属性强弱判断,为高频考点,根据物质中存在的化学键确定化合物类型,注意氢化物的熔沸点与相对分子质量与氢键有关,与非金属性强弱无关,易错选项是BD.

练习册系列答案
相关题目
1.下列参数比较及解释均正确的是( )
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
2.氢气是未来理想的能源,用MnFe2O4热化学循环制氢气的原理如下(x不为零):MnFe2O4→MnFe2O4-x(s)+$\frac{x}{2}$O2(g)△H1;MnFe2O4-x(s)+xH2O(g)═MnFe2O4(s)+xH2(g)△H2,下面说法正确的是( )
| A. | 上述两个反应都是氧化还原反应,且转移电子数相等 | |
| B. | Mn与Fe都属于ⅤⅡ族元素 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-2(△H1+△H2) | |
| D. | 根据两个反应可以看出,非自发反应加入合适的催化剂可以自发进行 |
1.一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-QkJ/mol.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在 I中充入1molCO和1molH2O,在Ⅱ中充入1molCO2和1mol H2,在Ⅲ中充入2molCO和2molH2O,700℃条件下开始反应.达到平衡时,上述三个过程对应的能量变化值分别为Q1、Q2、Q3.下列说法正确的是( )
| A. | 2Q1=2Q2<Q3 | |
| B. | 容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量高 | |
| C. | 容器Ⅰ中反应的平衡常数比容器Ⅱ中反应的平衡常数小 | |
| D. | 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
8.下列说法正确的是( )
| A. | 水高温条件下不易分解,是因为水分子内的H-O稳定 | |
| B. | 互为同分异构体的物质性质一定相似 | |
| C. | 分子组成若干个“CH12”原子团的有机化合物互称为同系物 | |
| D. | 因为互为同位素的核素的性质完全相同,所以这些核素在元素周期表中占据相同位置 |
 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域.
2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域. 、
、 .
. ②
② ③
③
 .
.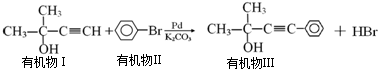

 则需要两种有机物的结构简式分别是HCHO和
则需要两种有机物的结构简式分别是HCHO和 或
或 和CH3MgBr
和CH3MgBr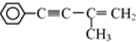 的反应方程式
的反应方程式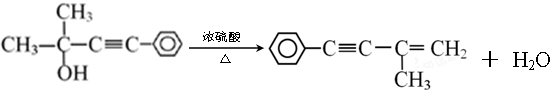
 CH3C≡CCH2OH+HI.
CH3C≡CCH2OH+HI. 为了探究化学能和热能的转化,某实验小组设计了如下三套实验装置:
为了探究化学能和热能的转化,某实验小组设计了如下三套实验装置: .
.
 .
. .
. .
.