题目内容
20.以硫酸铜溶液作电解液,对含有杂质的Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )①粗铜与直流电源正极相连
②阴极发生的反应为Cu2++2e-═Cu
③电路中每通过3.01×1023个电子,阴极质量增加16g,同时阳极一定减少16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
分析 ①电解精炼粗铜时,粗铜作阳极、纯铜作阴极,阳极与电源正极相连、阴极与电源负极相连;
②阳极上金属材料失电子发生氧化反应、阴极上铜离子得电子发生还原反应;
③阳极上不仅铜失电子,比铜活泼的金属也失电子;
④杂质Zn失电子生成锌离子进入溶液,杂质Ag以单质形式进入溶液.
解答 解:①电解精炼粗铜时,粗铜作阳极、纯铜作阴极,阳极与电源正极相连、阴极与电源负极相连,所以粗铜与电源正极相连,纯铜与电源负极相连,故正确;
②阳极上金属材料失电子发生氧化反应、阴极上铜离子得电子发生还原反应,阴极电极反应式为Cu2++2e-═Cu,故正确;
③阳极上不仅铜失电子,比铜活泼的金属也失电子,且锌的相对原子质量大于Cu,所以电路中每通过3.01×1023个电子,阴极质量增加16g,同时阳极减少质量可能大于16g,故错误;
④杂质Zn失电子生成锌离子进入溶液,杂质Ag以单质形式进入溶液而形成阳极泥,故错误;
故选A.
点评 本题以电解精炼粗铜为载体考查电解原理,明确各个电极上发生的反应是解本题关键,知道阳极泥形成原理,注意:电解时,阳极材料是较活泼金属时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
8.对于资源的合理开发利用,下列过程中只发生物理变化的是( )
| A. | 煤的干馏 | B. | 从海带中提取碘 | C. | 石油的分馏 | D. | 石油裂化 |
9.设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1 mol H2O中的氢原子数目为2NA | |
| C. | 阿伏加德罗常数个粒子的物质的量是1mol | |
| D. | 1mol NH3所含原子数约为2.408×1024个 |
8.下列说法正确的是( )
| A. | 水高温条件下不易分解,是因为水分子内的H-O稳定 | |
| B. | 互为同分异构体的物质性质一定相似 | |
| C. | 分子组成若干个“CH12”原子团的有机化合物互称为同系物 | |
| D. | 因为互为同位素的核素的性质完全相同,所以这些核素在元素周期表中占据相同位置 |
15.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述不正确的是( )
| A. | 锌锰干电池工作一段时间后锌皮变薄 | |
| B. | 铅蓄电池工作一段时间后两极板质量都增加 | |
| C. | 氢氧燃料电池将电能直接转变为化学能 | |
| D. | 银锌纽扣电池工作一段时间后有银单质生成 |
12.某无色溶液呈强酸性,则下列各组离子一定可以大量存在的是( )
| A. | Mg2+、Al3+、HCO3-、Cl- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | K+、NH4+、Cl-、SO42- | D. | Ba2+、Fe2+、Cl-、NO3- |
9.现有常温下pH均等于5的HCl溶液和NH4Cl溶液,下列说法正确的是( )
| A. | 两溶液中n (H+)相等 | B. | 两溶液中c(Cl-)相等 | ||
| C. | 两溶液中c(OH-)相等 | D. | 两溶液中水的电离程度相等 |
10.下列化学用语使用正确的是( )
| A. | 14C原子结构示意图: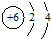 | B. | 硝基苯的结构简式: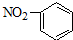 | ||
| C. | CO2的电子式: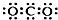 | D. | CH4分子的球棍模型: |
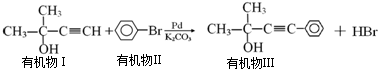

 则需要两种有机物的结构简式分别是HCHO和
则需要两种有机物的结构简式分别是HCHO和 或
或 和CH3MgBr
和CH3MgBr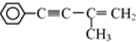 的反应方程式
的反应方程式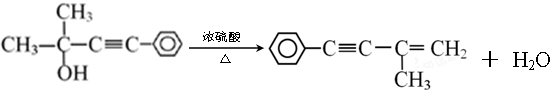
 CH3C≡CCH2OH+HI.
CH3C≡CCH2OH+HI.