题目内容
18. 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域.
2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域.在有机物分子中,若某个饱和碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如图:
若同一个碳原子上连着2个碳碳双键(如C=C=C)时,极不稳定,因此这种结构不存在,
某链烃C7H10的众多同分异构体中:
(1)处于同一平面上的碳原子数最多有C.
A.6个 B.5个 C.7个 D.4个
(2)含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的有5种.它们的结构简式除以下3种外,还有
 、
、 .
.①
 ②
② ③
③
(3)C7H10有多种结构,其中含有“手性碳原子”,但与足量H2发生加成反应后,产物却不具有“手性碳原子”,写出符合此条件的一种C7H10结构简式
 .
.
分析 某链烃C7H10的不饱和度=$\frac{7×2+2-10}{2}$=3,说明该分子中含有3个碳碳双键或1个碳碳双键和1个碳碳三键,
(1)C=C上的6个原子在同一平面上,C≡C上的4个原子在一条直线上;
(2)链烃C7H10,同一个碳原子形成2个碳碳双键(如C=C=C)时,不能稳定存在,则说明该烃中含有一个碳碳双键和一个碳碳三键,写出该烃中含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的同分异构体;
(3)含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”,则加成后出现了相同的基团
解答 解:(1)C=C上的6个原子在同一平面上,C≡C上的4个原子在一条直线上;则C7H10的众多同分异构体中,处于同一平面上的碳原子数最多的结构简式为: ,处于同一平面上的碳原子数为7;
,处于同一平面上的碳原子数为7;
故答案为:C;
(2)链烃C7H10,同一个碳原子形成2个碳碳双键(如C=C=C)时,不能稳定存在,则说明该烃中含有一个碳碳双键和一个碳碳三键,该烃中含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的同分异构体还有: ,
, ;
;
故答案为: ;
; ;
;
(3)含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”,则加成后出现了相同的基团,则其结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查常见有机物官能团及其结构,侧重考查学生分析判断能力,正确运用不饱和度确定结构中存在的碳碳键是解本题关键,知道“手性碳原子”特点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)9种元素中,化学性质最不活泼的是Ne,还原性最强的单质是Na.(用元素符号表示).
(2)③与⑧分别与氢形成的化合物沸点较高的是H2O(用化学式表示).
(3)请写出①与②元素形成的最简单的有机物的电子式: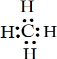
(4)④与⑨两种元素非金属性强弱顺序为:⑨<④(填“>”或“<”或“=”)
(5)⑥、⑦、⑧、⑨四种元素形成的简单离子中,离子半径最大的是S2-(用元素符号表示).
(6)⑦与⑥的最高价氧化物对应的水化物反应的化学反方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)③与⑧分别与氢形成的化合物沸点较高的是H2O(用化学式表示).
(3)请写出①与②元素形成的最简单的有机物的电子式:
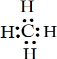
(4)④与⑨两种元素非金属性强弱顺序为:⑨<④(填“>”或“<”或“=”)
(5)⑥、⑦、⑧、⑨四种元素形成的简单离子中,离子半径最大的是S2-(用元素符号表示).
(6)⑦与⑥的最高价氧化物对应的水化物反应的化学反方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
13.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 稀硫酸能导电 | H2SO4为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
10.下列说法中正确的是( )
| A. | 升高温度,活化分子百分数增大,化学反应速率加快 | |
| B. | CO2、NH3的水溶液能导电,所以CO2、NH3是电解质 | |
| C. | 干冰升华这一过程中,△S<0 | |
| D. | Na2SO4溶液的导电能力一定比CH3COOH溶液强 |
 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.
原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.
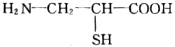
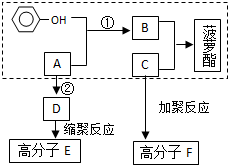 已知方框内是食品香精菠萝酯的生产路线,A、B又能发生方框外所示的转化关系.A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O.信息:-OH和碳碳双键不能连在同一个碳原子上.
已知方框内是食品香精菠萝酯的生产路线,A、B又能发生方框外所示的转化关系.A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O.信息:-OH和碳碳双键不能连在同一个碳原子上.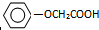 ;E
;E .
. .
. (有几种填写几种).
(有几种填写几种).