题目内容
15.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述不正确的是( )| A. | 锌锰干电池工作一段时间后锌皮变薄 | |
| B. | 铅蓄电池工作一段时间后两极板质量都增加 | |
| C. | 氢氧燃料电池将电能直接转变为化学能 | |
| D. | 银锌纽扣电池工作一段时间后有银单质生成 |
分析 A.锌锰干电池工作时碳棒不参与反应,活泼的金属锌放电;
B.铅蓄电池负极铅转化为硫酸铅,正极二氧化铅转化为硫酸铅;
C.氢氧燃料电池中,燃料在负极失电子;
D.银锌纽扣电池的反应原理为:Zn+Ag2O+H2O═Zn(OH)2+2Ag.
解答 解:A.锌锰干电池工作时碳棒不参与反应,所以碳棒质量不变,故A正确;
B.铅蓄电池负极铅转化为硫酸铅,正极二氧化铅转化为硫酸铅,所以两个电极质量都增加,故B正确;
C.燃料电池反应中没有发生燃烧反应,放出的热能很少,主要是把化学能直接转变为电能,故C错误;
D.银锌纽扣电池的反应原理为:Zn+Ag2O+H2O═Zn(OH)2+2Ag,所以电池工作一段时间后有银单质生成,故D正确;
故选C.
点评 本题考查较综合,涉及各种类型的原电池原理等知识点,根据原电池正负极上发生的反应即可解答,难度不大.

练习册系列答案
相关题目
3.2015年4月22日是第46个世界地球日.今年地球日主题为“珍惜地球资源 转变发展方式--提高资源利用效益”.下列行为符合活动主题的是( )
| A. | 到大草原去开荒种地 | |
| B. | 更新采煤、采油技术,提高产量以满足工业生产的快速发展. | |
| C. | 落实资源的“3R”发展观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) | |
| D. | 为粮食增产,多施用高效化肥、农药 |
4.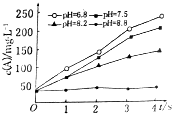 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )| A. | 若增大压强,该反应的反应速率一定增大 | |
| B. | pH=6.8时,随着反应的进行反应速率逐渐增大 | |
| C. | 一定pH范围内,溶液中H+浓度越小反应速率越快 | |
| D. | 可采用调节pH的方法使反应停止 |
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| B. | 已知酸性HF>CH3COOH,则pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-)=c(K+)-c(CH3COO-) | |
| C. | 0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸pH=b,则a+1=b | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4] |
10.1mol某烃A能与2molHCl完全加成,其产物最多能被8molCl2完全取代,则烃A可能为( )
| A. | 丁烯 | B. | 丁炔 | C. | 丙炔 | D. | 乙炔 |
7.NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 乙烯和环丙烷(C2H4)组成的28g混合气体中含有2NA个氢原子 | |
| C. | 15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
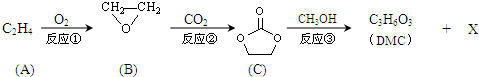
 ;XOHCH2CH2OH;
;XOHCH2CH2OH;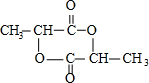 ;
;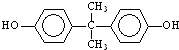 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n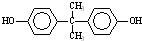 →
→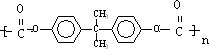 +4nCH3OH.
+4nCH3OH. 氟是非金属性最强的元素:回答下列问题:
氟是非金属性最强的元素:回答下列问题: ,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.
,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.