题目内容
16. 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题:(1)描述D在元素周期表中的位置:第二周期ⅥA族.
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(写化学式,下同),非金属最简单气态氢化物最不稳定的是CH4.
(3)写出满足下列条件分子的结构式
 .
.①所有原子最外层是8个电子;②C和E组成的化合物
(4)F与D同主族且相邻,D的氢化物比F的氢化物稳定的根本原因是氧的非金属性比硫强.用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出阳离子的电子式:
 .该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
分析 由短周期主族元素A、B、C、D、E在周期表中的位置知,B、C、D处于第二周期,A、E处于第三周期,A元素的简单离子半径在同周期元素的简单离子中最小,则A是Al元素,可推知B为碳元素、C为N元素、D为O元素、E为Cl,据此解答.
解答 解:由短周期主族元素A、B、C、D、E在周期表中的位置知,B、C、D处于第二周期,A、E处于第三周期,A元素的简单离子半径在同周期元素的简单离子中最小,则A是Al元素,可推知B为碳元素、C为N元素、D为O元素、E为Cl.
(1)D为O元素,在元素周期表中的位置:第二周期ⅥA族,故答案为:第二周期ⅥA族;
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是HClO4,非金属最简单气态氢化物最不稳定的是CH4,故答案为:HClO4;CH4;
(3)满足下列条件分子的结构式:①所有原子最外层是8个电子;②C和E组成的化合物,该分子结构式为: ,故答案为:
,故答案为: ;
;
(4)F与O同主族且相邻,则F为S元素,氧元素非金属性比硫强,故水比硫化氢稳定;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为: ,含有共价键,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
,含有共价键,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
故答案为:氧的非金属性比硫强; ;2H2O++H2S=S↓+2H2O+2H+.
;2H2O++H2S=S↓+2H2O+2H+.
点评 本题考查结构性质位置关系应用,根据元素的位置推断元素是解题的关键,涉及元素周期律应用、化学键、电子式、结构式、化学方程式书写等知识点,难度中等.

练习册系列答案
相关题目
4.下列各项中表达正确的是( )
| A. | Si的原子结构示意图: | |
| B. | 聚乙烯的结构简式 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{37}^{17}$Cl | |
| D. | HCl的电子式: |
1.已知酸性H2SO3>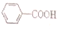 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )
 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 加稀硫酸共热后,再加入足量NaOH溶液 | |
| C. | 加热该物质溶液,再通入足量的SO2 | |
| D. | 与稀硫酸共热后,加入足量的Na2CO3 |
8.下列有关说法正确的是( )
| A. | 石油分馏出的各馏分均是纯净物 | |
| B. | 纤维素、淀粉、蛋白质和天然油脂都属于天然高分子化合物 | |
| C. | 煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2 | |
| D. | 1mol蔗糖在酸性条件下水解得到2mol葡萄糖 |

 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态. )俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:
)俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:

 ;
;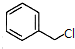 +
+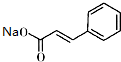 $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$ (写结构简式,若有多种可能,只写一种).
(写结构简式,若有多种可能,只写一种).