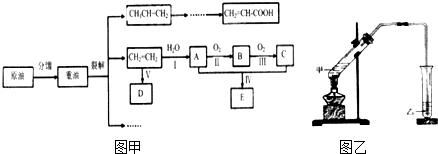
15.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到限度的标志是( )
| A. | 气体的平均相对分子质量不再改变 | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 单位时间内生成3n mol X,同时生成n mol Y |
14.相同状况下,某气态烃1体积只能与1体积氯气发生加成反应,生成氯代烃,此氯代烃1mol可与6mol氯气发生完全取代反应,则该烃的结构简式是( )
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |
13.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 7.80g Na2O2与5.85g NaCl所含阴离子数均为0.1NA | |
| B. | 一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,22.4LNH3所含分子数小于NA | |
| D. | 标准状况下,28g聚乙烯完全燃烧,产生的CO2数为2NA |
10.一定温度下,在甲、乙、丙三个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
| 甲 | 乙 | 丙 | ||
| 密闭容器体积/L | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率% | 80 | α1 | α2 | |
| A. | 该温度下,甲容器10min达到平衡,平均速率为v(SO3)=0.032 mol•L-1•min-1 | |
| B. | SO2的平衡转化率:α1<80% | |
| C. | 容器中SO3的物质的量浓度:2c(甲)>c(丙) | |
| D. | 甲中反应的平衡常数K为400 |
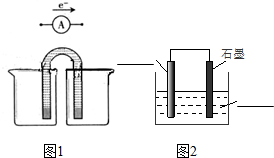
6.下列有关电池的说法不正确的是( )
0 169165 169173 169179 169183 169189 169191 169195 169201 169203 169209 169215 169219 169221 169225 169231 169233 169239 169243 169245 169249 169251 169255 169257 169259 169260 169261 169263 169264 169265 169267 169269 169273 169275 169279 169281 169285 169291 169293 169299 169303 169305 169309 169315 169321 169323 169329 169333 169335 169341 169345 169351 169359 203614
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铅蓄电池放电时,负极的质量逐渐减小 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
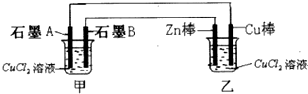
 将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
 .
. CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.
CH3COOC2H5+H2O,该反应类型是酯化(取代)反应. 2CH3CHO+2H2O.
2CH3CHO+2H2O.