题目内容
8.根据下图所示回答有关问题:(1)甲池为电解池(选填“原电池”或“电解池”),石墨A上发生的电极反应式为:2Cl--2e-═Cl2↑.
(2)乙池中Zn棒为负极,Zn棒上发生反应的电极反应式为:Zn-2e-=Zn2+.
(3)石墨B上刚好有9.6克物质析出时,则反应过程中转移的电子数为0.3NA.
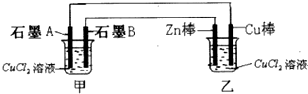
分析 乙为原电池,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,甲为电解池A为阳极,电极方程式为2Cl--2e-═Cl2↑,B为阴极,发生还原,电极方程式为Cu2++2e-=Cu,以此解答该题.
解答 解:(1)甲电极材料都为石墨,应为电解池,A连接乙的Cu棒,乙中铜为正极,则A为阳极,发生氧化反应,电极方程式为2Cl--2e-═Cl2↑,
故答案为:电解池; 2Cl--2e-═Cl2↑;
(2)乙为原电池,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,故答案为:负;Zn-2e-=Zn2+;
(3)石墨B上发生Cu2++2e-=Cu,刚好有9.6克物质析出时,即析出9.6g铜,物质的量为$\frac{9.6g}{64g/mol}$=0.15mol,则转移0.3mo电子,数目为0.3NA,
故答案为:0.3NA.
点评 本题考查了原电池和电解池原理,正确判断原电池和电解池是解本题关键,根据离子的放电顺序、串联电路中转移电子相等来分析解答,难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
19.微生物燃料电池(Microbial Fuel Cell,MFC)是一种利用微生物将有机物中的化学能直接转化成电能的装置.最早用于有机废水处理,下图是利用微生物燃料电池处理含甲醛废水的装置,其中3是质子交换膜,下列有关说法不正确的是:( )
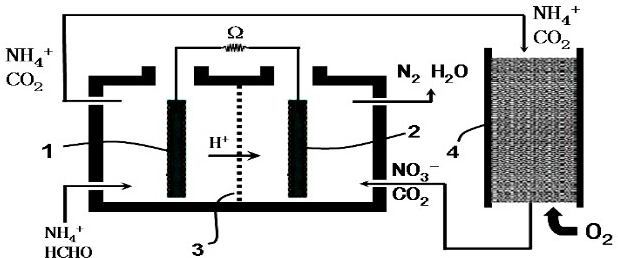

| A. | 负极发生的反应为:HCHO-4e-+H2O═CO2+4H+ | |
| B. | 负极所在的左室中需保持厌氧环境 | |
| C. | NH4+通过循环操作最终被转化成N2 | |
| D. | O2参与正极反应,发生还原反应 |
16.除去乙烷中混有的少量乙烯,正确的处理方法是( )
| A. | 将气体通入水 | B. | 将气体通入澄清石灰水 | ||
| C. | 将气体通入溴水 | D. | 将气体通入氯气进行光照 |
13.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 7.80g Na2O2与5.85g NaCl所含阴离子数均为0.1NA | |
| B. | 一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,22.4LNH3所含分子数小于NA | |
| D. | 标准状况下,28g聚乙烯完全燃烧,产生的CO2数为2NA |
20.“化学无处不在”,下列与化学有关的说法不正确的是( )
| A. | 由于甲酸的缘故,人被蜂蚁蜇咬后会感觉疼痛难忍,涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| B. | 用浸过酸性高锰酸钾溶液的硅藻土吸收水果、花朵产生的乙烯,可以延长果实或花朵的成熟期 | |
| C. | 将金属与电源正极相连可有效保护金属不被腐蚀 | |
| D. | 泡沫灭火器利用双水解原理喷出泡沫覆盖在燃烧物品上,使燃着的物质与空气隔离,并降低温度,达到灭火的目的 |
17.下列应用不涉及到盐类水解的是( )
| A. | 用热的纯碱清洗油污 | B. | 氯气难溶于NaCl溶液中 | ||
| C. | 明矾的净水作用 | D. | 泡沫灭火器的使用原理 |
18.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | 原子半径:D>E>C>B>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
 VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态.含VA族元素的化合物在研究和生回答下列问题:
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态.含VA族元素的化合物在研究和生回答下列问题: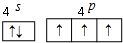 .N、P、As原子的第一电离能由大到小的顺序为N>P>As.
.N、P、As原子的第一电离能由大到小的顺序为N>P>As. .
.