题目内容
13.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )| A. | 7.80g Na2O2与5.85g NaCl所含阴离子数均为0.1NA | |
| B. | 一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,22.4LNH3所含分子数小于NA | |
| D. | 标准状况下,28g聚乙烯完全燃烧,产生的CO2数为2NA |
分析 A.过氧化钠中阴离子为过氧根离子,7.80g过氧化钠的物质的量为0.1mol,含有0.1mol过氧根离子;
B.氮气与氢气的反应为可逆反应,反应物不可能完全转化成生成物;
C.常温常压下,温度高于标况下,所以气体摩尔体积大于22.4L/mol;
D.聚乙烯为乙烯通过加聚反应生成的产物,聚乙烯的最简式为CH2,根据最简式计算出28g聚乙烯中含有的碳原子数目.
解答 解:A.7.80g过氧化钠的物质的量为0.1mol,含有0.1mol过氧根离子,5.85g NaCl的物质的量为0.1mol,含有0.1mol氯离子,所以二者所含阴离子数均为0.1NA,故A正确;
B.1.4g氮气的物质的量为0.05mol,0.05mol氮气完全反应生成0.1mol氨气,转移了0.3mol电子,由于合成氨的反应为可逆反应,所以反应注意的电子一定小于0.3mol,转移的电子数小于0.3NA,故B错误;
C.常温常压下,气体摩尔体积大于22.4L/mol,则22.4L氨气的物质的量小于1mol,所含分子数小于NA,故C正确;
D.28g聚乙烯中含有2mol最简式CH2,含有2mol碳原子,根据碳原子守恒,完全燃烧生成2mol二氧化碳,产生的CO2数为2NA,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,注意可逆反应的特点.

练习册系列答案
相关题目
1.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)⑧元素氢化物的电子式是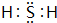 .
.
(2)②、③、⑤元素的原子半径由大到小的顺序为Na>C>N.
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是H2O>CH4>SiH4.
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,则该反应的离子方程式为H++HSO3-=H2O+SO2↑.
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
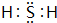 .
.(2)②、③、⑤元素的原子半径由大到小的顺序为Na>C>N.
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是H2O>CH4>SiH4.
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,则该反应的离子方程式为H++HSO3-=H2O+SO2↑.
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
5.关于下列装置说法正确的是( )

| A. | 装置①中,一段时间后SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,a极附近变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中发生吸氧腐蚀 |
3.在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是( )
| A. | 在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 | |
| B. | 在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3 | |
| C. | 在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
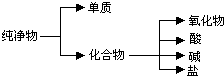 (1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)
(1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)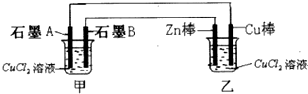

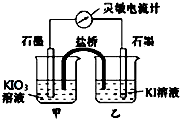 将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.
将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.