题目内容
10.一定温度下,在甲、乙、丙三个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )| 甲 | 乙 | 丙 | ||
| 密闭容器体积/L | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率% | 80 | α1 | α2 | |
| A. | 该温度下,甲容器10min达到平衡,平均速率为v(SO3)=0.032 mol•L-1•min-1 | |
| B. | SO2的平衡转化率:α1<80% | |
| C. | 容器中SO3的物质的量浓度:2c(甲)>c(丙) | |
| D. | 甲中反应的平衡常数K为400 |
分析 SO2和O2反应生成SO3方程式为2SO2(g)+O2(g)?2SO3(g),
A.该温度下,甲容器10min达到平衡,根据SO2转化率及方程式知,参加反应的△n(SO3)=△n(SO2)=0.40mol×80%=0.32mol,平均速率为v(SO3)=$\frac{\frac{△n}{V}}{△t}$;
B.乙中相当于在甲反应达到平衡状态的基础上再加入0.40molSO2,虽然平衡向正反应方向移动,但SO2转化率降低;
C.丙中反应物浓度是甲的2倍,如果将丙容器容积增大为甲的2倍,则甲、丙为等效平衡,甲、丙中c(SO3)相等,然后将丙中容积缩小为和甲相同,则相当于增大压强,如果平衡不移动,则丙中c(SO3)是甲的2倍,实际上平衡向正反应方向移动,则丙中c(SO3)大于甲的2倍;
D.甲中反应达到平衡状态时,△c(SO3)=$\frac{0.32mol}{2L}$=0.16mol/L,△c(O2)=$\frac{0.24mol-0.32mol×\frac{1}{2}}{2L}$=0.04mol/L,△c(SO2)=$\frac{0.40mol×(1-80%)}{2L}$=0.04mol/L,根据平衡常数公式计算该温度下的平衡常数.
解答 解:SO2和O2反应生成SO3方程式为2SO2(g)+O2(g)?2SO3(g),
A.该温度下,甲容器10min达到平衡,根据SO2转化率及方程式知,参加反应的△n(SO3)=△n(SO2)=0.40mol×80%=0.32mol,平均速率为v(SO3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.32mol}{2L}}{10min}$=0.016mol/(L.min),故A错误;
B.乙中相当于在甲反应达到平衡状态的基础上再加入0.40molSO2,虽然平衡向正反应方向移动,但加入的n(SO2)远远大于转化的n(SO2)增加量,所以SO2转化率降低,则SO2的平衡转化率:α1<80%,故B正确;
C.丙中反应物浓度是甲的2倍,如果将丙容器容积增大为甲的2倍,则甲、丙为等效平衡,甲、丙中c(SO3)相等,然后将丙中容积缩小为和甲相同,则相当于增大压强,如果平衡不移动,则丙中c(SO3)是甲的2倍,实际上平衡向正反应方向移动,则丙中c(SO3)大于甲的2倍,所以容器中SO3的物质的量浓度:2c(甲)<c(丙),故C错误;
D.甲中反应达到平衡状态时,△c(SO3)=$\frac{0.32mol}{2L}$=0.16mol/L,△c(O2)=$\frac{0.24mol-0.32mol×\frac{1}{2}}{2L}$=0.04mol/L,△c(SO2)=$\frac{0.40mol×(1-80%)}{2L}$=0.04mol/L,该温度下的平衡常数K=$\frac{(0.16)^{2}}{(0.04)^{2}×0.04}$=400,故D正确;
故选BD.
点评 本题考查化学平衡计算,为高频考点,正确构建等效平衡是解本题关键,难点是BC选项,要利用中间状态构建等效平衡,然后再利用外界条件对平衡的影响分析解答,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 油脂属于脂类 | B. | 油脂都不能使溴水褪色 | ||
| C. | 油脂没有固定的熔沸点 | D. | 油脂是高级脂肪酸的甘油酯 |
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 |
| A. | 甲烷 | B. | 四氯化碳 | C. | 乙烯 | D. | 苯 |
| A. | 气体的平均相对分子质量不再改变 | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 单位时间内生成3n mol X,同时生成n mol Y |
| A. | 先配制0.10 mol/L CH3COOH溶液,再测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 先配制0.01 mol/L和0.10 mol/L的CH3COOH,再分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 | |
| C. | 取等体积、等pH的CH3COOH的溶液和盐酸分别与足量锌反应,测得反应过程中醋酸产生H2速率较慢且最终产生H2较多,则可证明醋酸为弱电解质 | |
| D. | 配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
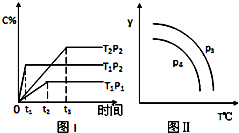 在某容积一定的密闭容器中,有下列可逆反应xA(g)+B(g)?2C(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )
在某容积一定的密闭容器中,有下列可逆反应xA(g)+B(g)?2C(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )| A. | 该反应是吸热反应 | |
| B. | x=2 | |
| C. | P3<P4,y轴可表示混合气体的相对分子质量 | |
| D. | P3>P4,y轴可表示C物质在平衡体积中的百分含量 |
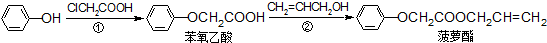
| A. | 步骤①产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 步骤②产物中残留的CH2=CHCH2OH可用溴水检验 | |
| C. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| D. | 苯氧乙酸和菠萝酯均可与H2在一定条件下发生反应 |