题目内容
9.乙烯是来自石油的重要有机化工原料.结合以下路线回答问题:已知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
.(2)E是有香味的物质,实验室制取E的装置如图2所示.
①反应Ⅳ的化学方程式是CH3COOH+C2H5OH
 CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.
CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.②该装置图中有一个明显的错误是乙试管中导管插入液面下.
③反应开始前,试管乙中盛放的溶液的作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解性,可用分液的方法把制得的E分离出来.
(3)反应Ⅰ的化学方程式是CH2=CH2+H2O$\stackrel{一定条件}{→}$CH2CH3OH.
反应Ⅱ的化学方程式是2CH3CH2OH+O2
 2CH3CHO+2H2O.
2CH3CHO+2H2O.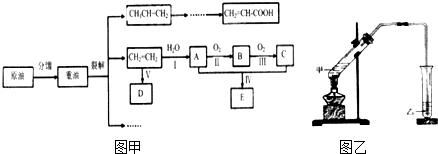
分析 乙烯含有碳碳双键,能发生加聚反应,生成聚乙烯,则D是聚乙烯.乙烯和水发生加成反应生成乙醇,则A是乙醇.乙醇发生氧化反应生成B,所以B是乙醛.乙醛继续被氧化生成乙酸,所以C是乙酸.乙酸和乙醇发生酯化反应生成乙酸乙酯,则E是乙酸,以此解答(1)(3);
(2)中制备乙酸乙酯由于生成的乙酸乙酯中含有乙酸和乙醇,二者都是与水互溶的,吸收装置中如果直接插入到碳酸钠溶液中,容易引起倒吸.
解答 解:石油分馏时不产生新物质,重油裂解生成的乙烯和水发生加成反应生成A乙醇,铜或银作催化剂、加热条件下,乙醇被氧气氧化生成乙醛和水,反应方程式为:
2CH3CH2OH+O2$→_{△}^{Cu/或Ag}$2CH3CHO+2H2O,B为CH3CHO,B催化氧化生成C,C为乙酸,在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯和水,E为乙酸乙酯,反应方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
(1)乙烯发生加聚反应的化学方程式为 ,聚乙烯结构简式为:
,聚乙烯结构简式为: ,
,
故答案为: ;
;
(2)①C和A反应生成C是乙酸与乙醇反应生成乙酸乙酯,反应方程式为 CH3COOH+C2H5OH CH3COOC2H5+H2O,该反应的类型为酯化(取代)反应,
CH3COOC2H5+H2O,该反应的类型为酯化(取代)反应,
故答案为:CH3COOH+C2H5OH CH3COOC2H5+H2O;酯化(取代)反应;
CH3COOC2H5+H2O;酯化(取代)反应;
②由于乙醇和乙酸易溶于饱和碳酸钠溶液,若导管末端若插入液面以下,容易发生倒吸现象,所以导管不能插入液面以下,
故答案为:乙试管中导管插入液面下;
③乙为饱和碳酸钠溶液,可溶解乙醇,中和乙酸,易乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,
故答案为:溶解乙醇,中和乙酸,降低乙酸乙酯的溶解性;分液;
(3)反应Ⅰ为乙烯与水的加成反应,方程式为CH2=CH2+H2O $\stackrel{一定条件}{→}$CH2CH3OH,反应Ⅱ为乙醇的催化氧化,生成乙醛,方程式为2CH3CH2OH+O2 2CH3CHO+2H2O,
2CH3CHO+2H2O,
故答案为:CH2=CH2+H2O $\stackrel{一定条件}{→}$CH2CH3OH;2CH3CH2OH+O2 2CH3CHO+2H2O.
2CH3CHO+2H2O.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,题目难度不大,属于高考热点基础题型.

(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 升高温度可加快逆反应速率但不能改变正反应速率 | |
| C. | 一定条件下,SO2可100%转化为SO3 | |
| D. | 任何条件下,反应达到平衡,SO2的浓度一定等于SO3的浓度 |
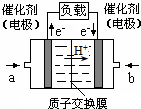 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| C. | 电池负极的反应式为:CH3OH+H2O═CO2+6H++4e- | |
| D. | 电池正极的反应式为:O2+2H2O+4e-═4OH- |
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | C. | $\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ | D. | Ka(CH3COOH) |
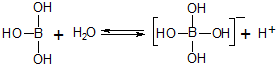
| A. | 硼酸加入水中抑制水的电离 | |
| B. | 硼酸是三元酸 | |
| C. | 硼酸与强碱在溶液中反应:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |