3.下列反应中,离子方程式书写正确的是( )
| A. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 氢氧化钡与盐酸反应:OH-+H+=H2O |
2.下列反应的离子方程式正确的是( )
| A. | 氧化铝和氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| B. | 硫酸溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 氯化铝中加入过量的氢氧化钠:Al3++3OH-═Al(OH)3↓ |
1.在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为( )
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 |
20.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据表中所列键能数据估算a的数值为-93.
(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1.如果该反应△S=+133.7J•K-1•mol-1该反应在常温(25℃)下能否自发进行?(△G=△H-T△S)不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行.(填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
19.微生物燃料电池(Microbial Fuel Cell,MFC)是一种利用微生物将有机物中的化学能直接转化成电能的装置.最早用于有机废水处理,下图是利用微生物燃料电池处理含甲醛废水的装置,其中3是质子交换膜,下列有关说法不正确的是:( )
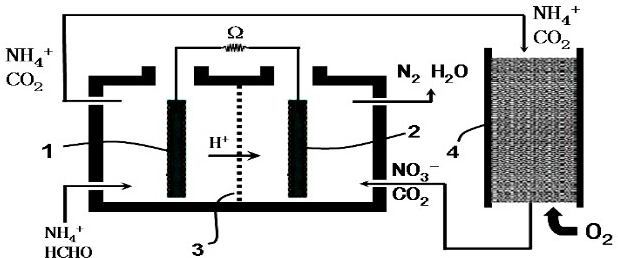

| A. | 负极发生的反应为:HCHO-4e-+H2O═CO2+4H+ | |
| B. | 负极所在的左室中需保持厌氧环境 | |
| C. | NH4+通过循环操作最终被转化成N2 | |
| D. | O2参与正极反应,发生还原反应 |
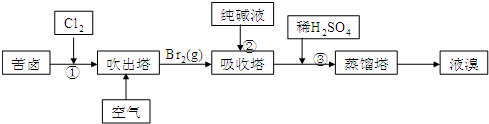
17. 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:
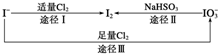
(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
根据表中数据,可得出的两条结论是①条件相同时,I3-离子的物质的量分数组成始终占绝对优势(或I3-含量高,I42-含量低)、②?随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加.;
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
16.制备食用碘盐(KIO3)原理之一为:I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3,下列说法正确的是( )
0 169162 169170 169176 169180 169186 169188 169192 169198 169200 169206 169212 169216 169218 169222 169228 169230 169236 169240 169242 169246 169248 169252 169254 169256 169257 169258 169260 169261 169262 169264 169266 169270 169272 169276 169278 169282 169288 169290 169296 169300 169302 169306 169312 169318 169320 169326 169330 169332 169338 169342 169348 169356 203614
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |

 .
.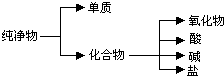 (1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)
(1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)