题目内容
18.用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: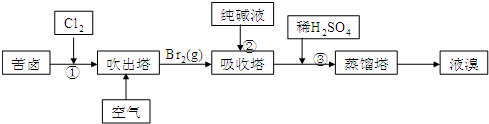
(1)若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑.
(2)通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?富集溴,提高Br2的浓度.
(3)向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
分析 由流程可知,①中发生2Br-+Cl2=2Cl-+Br2,利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在吸收塔中的溶液含BrO3-,可知发生3CO32-+3Br2=5Br-+BrO3-+3CO2↑,③中发生5Br-+BrO3-+6H+=3Br2+3H2O,最后利用蒸馏得到溴,以此来解答.
解答 解:由流程可知,①中发生2Br-+Cl2=2Cl-+Br2,利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在吸收塔中的溶液含BrO3-,可知发生3CO32-+3Br2=5Br-+BrO3-+3CO2↑,③中发生5Br-+BrO3-+6H+=3Br2+3H2O,最后利用蒸馏得到溴,
(1)纯碱是碳酸钠,与溴反应有BrO3-生成,反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,故答案为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑;
(2)从①出来的溶液中溴的含量不高,如果直接蒸馏,得到产品成本高,所以经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的为富集溴,提高Br2的浓度,
故答案为:富集溴,提高Br2的浓度;
(3)温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏,故答案为:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
点评 本题考查混合物分离提纯及溴的制备,为高频考点,把握流程中的反应及物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列表示物质结构的化学用语或模型图正确的是( )
| A. | H2O2的电子式: | B. | CS2的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 苯的分子式: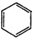 |
19.下列物质中不能用来区分乙酸、乙醇、苯的是( )
| A. | 溴水 | B. | 碳酸钠溶液 | C. | 紫色石蕊试液 | D. | 金属钠 |
6.设NA为阿伏加德罗常数的值.下列说法一定正确的是( )
| A. | 将含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 | |
| B. | 常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA | |
| C. | 将0.1molCl2通入1L水中,转移的电子数为0.1NA | |
| D. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数一定为0.1NA |
13.设nA为阿伏加德罗常数的数值,下列说法错误的是(H:1 O:16)( )
| A. | 常温下,1.8g H2O含有0.2nA个H-O共价键 | |
| B. | 1L 0.3 mol•L-1的FeCl3溶液中Fe3+数目为0.3nA | |
| C. | 标准状况下,22.4L CCl4中含 nA个CCl4分子 | |
| D. | 标准状况下,22.4L NO2和CO2的混合气体含有2nA个氧原子 |
3.下列反应中,离子方程式书写正确的是( )
| A. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 氢氧化钡与盐酸反应:OH-+H+=H2O |
10. 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
(1)由上述资料2可得出的正确结论是abd(选填下列字母编号)
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15mol•L-1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)Cu与足量16mol•L-1浓硫酸反应时,在80°C以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250°C左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为CuS+4H2SO4=CuSO4+4SO2↑+4H2O.
Ⅱ.产物性质探究
Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3,Cu(OH)2,或者CuCO3与Cu(OH)2的混合物.
(1)若沉淀是Cu(OH)2,生成沉淀的离子方程式是Cu2++2HCO3-=Cu (OH)2↓+2CO2↑.
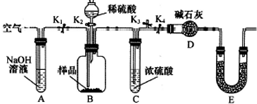
(2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1,K3,关闭K2,K4,通入足量空气
c.关闭K1,K3,打开K2,K4,充分反应
d.反应结束后,关闭K2,打开K1,再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是排尽装置中空气中的CO2使测定结果准确
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为38%,若不进行步骤d,则会使测得Cu(OH)2的质量分数为偏低(填“偏高”“无影响”“偏低”)
 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15mol•L-1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)Cu与足量16mol•L-1浓硫酸反应时,在80°C以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250°C左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为CuS+4H2SO4=CuSO4+4SO2↑+4H2O.
Ⅱ.产物性质探究
Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3,Cu(OH)2,或者CuCO3与Cu(OH)2的混合物.
(1)若沉淀是Cu(OH)2,生成沉淀的离子方程式是Cu2++2HCO3-=Cu (OH)2↓+2CO2↑.
(2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1,K3,关闭K2,K4,通入足量空气
c.关闭K1,K3,打开K2,K4,充分反应
d.反应结束后,关闭K2,打开K1,再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是排尽装置中空气中的CO2使测定结果准确
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为38%,若不进行步骤d,则会使测得Cu(OH)2的质量分数为偏低(填“偏高”“无影响”“偏低”)
8.已知25℃、101kPa下,下列反应
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
| A. | 金刚石比石墨稳定 | |
| B. | 1 mol石墨所具有的能量比1 mol金刚石低 | |
| C. | 金刚石转变成石墨是物理变化 | |
| D. | 石墨和金刚石都是碳的同位素 |