题目内容
1.在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为( )| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 |
分析 1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则1mol乙烷完全燃烧生成液体水放出的热量为52kJ×$\frac{1mol×30g/mol}{1g}$=1560kJ,则△H=-1560kJ•mol-1,注明物质的聚集状态书写热化学方程式,注意反应焓变与乙烷的化学计量数成正比关系.
解答 解:1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则1mol乙烷完全燃烧生成液体水放出的热量为52kJ×$\frac{1mol×30g/mol}{1g}$=1560kJ,则△H=-1560kJ•mol-1,则乙烷燃烧的热化学方程式为:C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1,
若乙烷为2mol,则其燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3120 kJ•mol-1,
故选:A.
点评 本题主要考查学生热化学方程式的书写,注意焓变的正负和单位问题、物质的聚集状态,该题型是考试的热点.

练习册系列答案
相关题目
1.下列说法不正确的是( )
| A. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| B. | 气态单质分子中一定存在共价键 | |
| C. | 氢元素即可与氯元素形成共价键也可与钠元素形成离子键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
16.制备食用碘盐(KIO3)原理之一为:I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3,下列说法正确的是( )
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |
6.全部属于纯净物的组合是( )
| A. | 福尔马林、白酒、食醋 | B. | 汽油、油脂、酚醛树脂 | ||
| C. | 石炭酸、盐酸、冰醋酸 | D. | 甘油、乙醇钠、氯仿 |
13.下列说法正确的是( )
| A. | 乙烯的年产量通常用来衡量一个国家的石油化工发展水平 | |
| B. | 煤的干馏属于物理变化 | |
| C. | 石油裂化的主要目的是除去石油中的杂质 | |
| D. | 压缩天然气和液化石油气的主要成分均为一氧化碳 |
10.一定温度下,在甲、乙、丙三个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
| 甲 | 乙 | 丙 | ||
| 密闭容器体积/L | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率% | 80 | α1 | α2 | |
| A. | 该温度下,甲容器10min达到平衡,平均速率为v(SO3)=0.032 mol•L-1•min-1 | |
| B. | SO2的平衡转化率:α1<80% | |
| C. | 容器中SO3的物质的量浓度:2c(甲)>c(丙) | |
| D. | 甲中反应的平衡常数K为400 |
11.下列各组物质中,一定属于同系物的是( )
| A. | C2H4和C4H8 | B. | 苯和甲苯 | C. | 乙二醇和丙三醇 | D. | 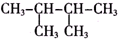 和 和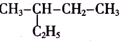 |