题目内容
16.制备食用碘盐(KIO3)原理之一为:I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3,下列说法正确的是( )| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |
分析 A.KClO3不能电离出Cl-;
B.I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3中,I元素的化合价升高,Cl元素的化合价降低;
C.KClO3和KIO3均含离子键、共价键;
D.制备KIO3的反应中,Cl元素的化合价由+5价降低为0.
解答 解:A.KClO3不能电离出Cl-,则不能与AgNO3溶液反应生成白色AgCl沉淀,故A错误;
B.I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3中,I元素的化合价升高,Cl元素的化合价降低,则非金属性Cl>I,故B错误;
C.KClO3和KIO3均含离子键、共价键,均为离子化合物,故C错误;
D.制备KIO3的反应中,Cl元素的化合价由+5价降低为0,得到电子被还原,故D正确;
故选D.
点评 本题考查含氯化合物的性质及氧化还原反应,为高频考点,把握反应中元素的化合价变化、物质的性质、构成为解答的解答的关键,综合性较强,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
17.下列反应的离子方程式书写正确的是( )
| A. | 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-═2Fe2++I2 | |
| B. | 含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | CaCO3溶于醋酸:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+2H2O | |
| D. | 向海带灰浸出液中加入硫酸、双氧水:2I-+H2O2═2OH-+I2 |
4.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 1mol SiO2中含有NA个SiO2分子 | |
| B. | 1mol Cu与足量的稀HNO3反应,转移2 NA个电子 | |
| C. | 1 LO.1mol•L-1Na2CO3 溶液中含有 0.1NA 个CO${\;}_{3}^{2-}$ | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4Na |
11.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,78g Na202中含有的阴离子数为2NA | |
| B. | 常温下,1L 0.1 mol/L NH4NO3溶液中含有的NH4 +数为0.1NA | |
| C. | 标准状况下,22.4 L己烷中含有的共价键的数目为19 NA | |
| D. | 30 g SiO2晶体中含有Si-O键的数目为2 Na |
1.在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为( )
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 |
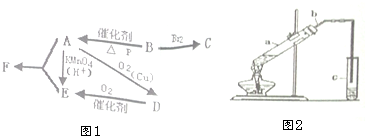 有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题:
有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题: .
.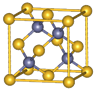 Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3,+6,单质硬度大,耐腐蚀,是重要的合金材料.
Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3,+6,单质硬度大,耐腐蚀,是重要的合金材料.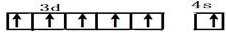 ,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.