3.将铁棒和锌棒用导线连接插入CuSO4溶液里,当电池中有0.2mol电子通过时,负极质量的变化是( )
| A. | 增加6.5g | B. | 减少6.5g | C. | 减少5.6g | D. | 增加6.4g |
18.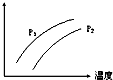 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )| A. | 混合物中L的百分含量 | B. | 混合气体的密度 | ||
| C. | L的转化率 | D. | 混合气体的平均分子量 |
17.下列叙述及解释正确的是( )
0 169079 169087 169093 169097 169103 169105 169109 169115 169117 169123 169129 169133 169135 169139 169145 169147 169153 169157 169159 169163 169165 169169 169171 169173 169174 169175 169177 169178 169179 169181 169183 169187 169189 169193 169195 169199 169205 169207 169213 169217 169219 169223 169229 169235 169237 169243 169247 169249 169255 169259 169265 169273 203614
| A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |

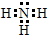 .
. ,
,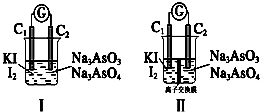

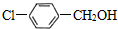 、
、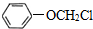 (写两种)
(写两种) ,
,
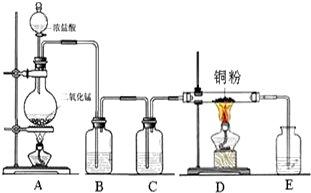 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: