题目内容
20.A、B、C、D、E、F六种短周期元素,原子序数依次增大.A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍.B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数.D元素原子最外层电子数是次外层电子数的一半.回答下列问题:(1)写出E、F形成化合物所含化学键的类型共价键;A元素在周期表中的位置是第二周期ⅥA族
(2)D、E、F的最高价氧化物的水化物酸性强弱顺序HClO4>H2SO4>H2SiO3(用化学式表示)
(3)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
(4)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O.
分析 A、B、C、D、E、F六种短周期元素,原子序数依次增大.A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍,则A为氧元素,E为硫元素;D元素原子最外层电子数是次外层电子数的一半,D元素的原子序数大于氧元素,则D有3个电子层,故最外层电子数为4,故D为硅元素;B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,则B、C最外层电子数之和为4,B、C原子序数大于氧元素,则B、C两元素不可能为同族元素,最外层电子数为1、3组合,原子序数B小于C,故B为钠元素,C为铝元素;C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数,则F元素原子最外层电子数为3+4=7,故F为氯元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,原子序数依次增大.A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍,则A为氧元素,E为硫元素;D元素原子最外层电子数是次外层电子数的一半,D元素的原子序数大于氧元素,则D有3个电子层,故最外层电子数为4,故D为硅元素;B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,则B、C最外层电子数之和为4,B、C原子序数大于氧元素,则B、C两元素不可能为同族元素,最外层电子数为1、3组合,原子序数B小于C,故B为钠元素,C为铝元素;C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数,则F元素原子最外层电子数为3+4=7,故F为氯元素.
(1)S、Cl形成化合物所含化学键为共价键,A为氧元素,处于周期表中第二周期ⅥA族,
故答案为:共价键;第二周期ⅥA族;
(2)非金属性越强,最高价含氧酸的酸性越强,非金属性Cl>S>Si,故酸性HClO4>H2SO4>H2SiO3,
故答案为:HClO4>H2SO4>H2SiO3;
(3)C、E对应的最高价氧化物的水化物为Al(OH)3、H2SO4,二者反应方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,
故答案为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;
(4)C、D的氧化物分别为:Al2O3、SiO2,B的氢氧化物为NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为:SiO2+2OH-=SiO32-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;SiO2+2OH-=SiO32-+H2O.
点评 本题考查性质结构与位置关系应用,推断元素是关键,充分利用核外电子排布规律及结构与位置关系进行推断,是对学生综合能力的考查.

| A. | 1.4 g | B. | 15.4 g | C. | 4.4 g | D. | 12.4 g |
| A. | N原子价层轨道表示式: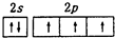 | |
| B. | H2O电子式为 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | 钾(K)原子的原子结构示意图为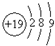 |
 有机物A、B、C、D有如下转化关系.回答下列问题:
有机物A、B、C、D有如下转化关系.回答下列问题: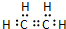 ,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键).
,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键).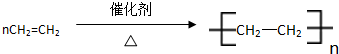 ,反应类型:加聚反应.
,反应类型:加聚反应.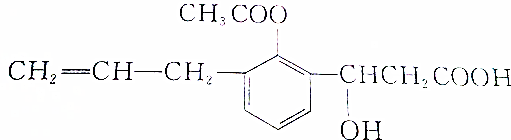

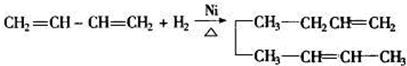
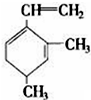 ,当它与等物质的量的Br2的水溶液发生加成反应时有多种产物,请补写除给出的两种结构外的其他三种产物的结构简式.
,当它与等物质的量的Br2的水溶液发生加成反应时有多种产物,请补写除给出的两种结构外的其他三种产物的结构简式.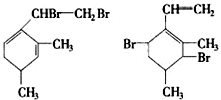
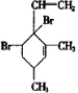
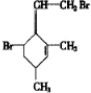
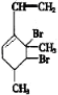 .
.
 .
.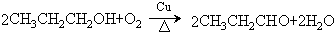 .
.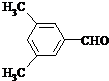 、
、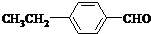 .
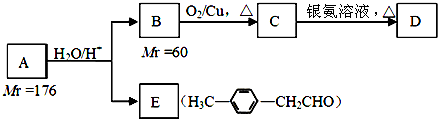
. )的合成路线流程图如下:
)的合成路线流程图如下: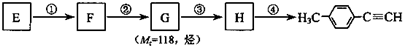
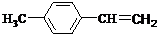 ,③的反应类型为加成反应.
,③的反应类型为加成反应.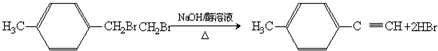 .
.