题目内容
19.现有A、B、C、D、E五种短周期主族元素,其原子序数依次增大,它们之间关系如下:Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的核外电子层数:B=C=2A
Ⅲ.B元素的主要化合价:最高正价+最低负价=2
Ⅳ.C是周期表中非金属性最强的元素
V.原子的最外层电子数:B+D=8
VI.E是同周期中半径最小的原子
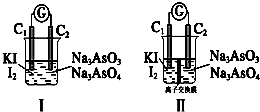
请回答:
(1)实验室制取E的单质反应离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+C12↑.
(2)只有A和B两种元素组成的属于离子晶体的化合物可能为NH4H(或(NH4)3N、NH4N3)(用化学式表示).
(3)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
下列可作为比较D和Mg金属性强弱的方法是bc(填代号).
a.测两种元素单质的硬度和熔、沸点 b.比较最高价氧化物对应的水化物的碱性强弱
c.比较单质与同浓度盐酸反应的剧烈程度 d..比较两种元素在化合物中化合价的高低
(4)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化合物与水反应的化学方程式3NF3+5H2O=HNO3+2NO↑+9HF.
(5)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,写出检验该盐中所含阳离子的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
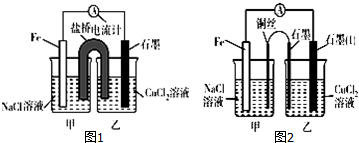
(6)下图Ⅰ、Ⅱ分别是甲、乙两组同学将与B元素同主族的砷元素的化合物按反应“AsO43-+2I-+2H+?AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量40%NaOH溶液,发现电流表指针发生偏转.
①甲组电流表指针都不发生偏转的原因是氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过.
②乙组添加的是阳(填“阴”或“阳”)离子交换膜.
分析 A、B、C、D、E五种短周期主族元素,其原子序数依次增大,原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:B+D=8,则D的最外层电子数为8-5=3,D的原子序数大于N元素,则D为Al元素;C是周期表中非金属性最强的元素,则C为F元素;E是同周期中半径最小的原子,E处于第三周期,则E为Cl元素,据此进行解答(1)~(5);
(6)①甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸,发生氧化还原反应,不发生原电池反应;
②乙组向图ⅡB烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,发生原电池反应,A中发生I2+2e-═2I-,为正极反应,而B中As化合价升高,发生氧化反应,以此分析.
解答 解:A、B、C、D、E五种短周期主族元素,其原子序数依次增大,原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:B+D=8,则D的最外层电子数为8-5=3,D的原子序数大于N元素,则D为Al元素;C是周期表中非金属性最强的元素,则C为F元素;E是同周期中半径最小的原子,E处于第三周期,则E为Cl元素,
(1)实验室制取氯气是二氧化锰和浓盐酸共热,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+C12↑,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+C12↑;
(2)A、B分别为N、H元素,N和H组成的离子化合物一定含有铵根离子,可能为:NH4H 或( NH4)3N、NH4N3,
故答案为:NH4H(或( NH4)3N、NH4N3);
(3)由D元素形成的氢氧化物为Al(OH)3,Al(OH)3和NaOH反应的离子方程式为:Al(OH)3+OH-=AlO2-+H2O;
a.金属性强弱与两种元素单质的硬度和熔、沸点无关,故a错误;
b.金属元素的最高价氧化物对应水化物的碱性越弱,金属性越弱,故b正确;
c.金属性越强,单质与同浓度盐酸反应的剧烈程度就越大,故c正确
d.金属性强弱与化合价高低无关(即与失去电子数多少),与难易程度有关,故d错误;
故答案为:Al(OH)3+OH-=AlO2-+H2O;bc;
(4)由B、C元素组成的化合物BC3,为NF3,该化合物具有强氧化性,与水反应生成两种酸HNO3、HF和一种无色气体,该气体常温下遇空气变红棕色为NO,该化合物与水反应的化学方程式:3NF3+5H2O=HNO3+2NO↑+9HF;
故答案为:3NF3+5H2O=HNO3+2NO↑+9HF;
(5)A、B和C三种元素组成的盐为NH4F,铵根离子部分水解,溶液显示酸性,检验铵根离子的反应为:取少量该盐溶液于一支试管中,加入过量的浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验,若变蓝,则有NH4+,反之无NH4+,涉及的反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(6)①甲组操作时,两个电极均为碳棒,不发生原电池反应,则微安表(G)指针不发生偏转,
故答案为:氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过;
②乙组向图ⅡB烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,发生原电池反应,A中发生I2+2e-═2I-,为正极反应,而B中As化合价升高,发生氧化反应,添加了阳离子交换膜,
故答案为:阳.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

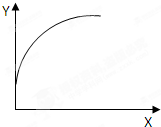 在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )| X | Y | |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 再加入C | A的质量分数 |
| C | 再加入A | B的转化率 |
| D | 压强 | B的浓度 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH2=CH-COOH | B. | CH2=CH-COOCH3 | C. | CH3CH2OH | D. | CH2=CH-CH2OH |
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 单质与氢气化合的难易程度:Z>L | |
| B. | Y的氧化物对应的水化物不能溶于过量的氨水 | |
| C. | Z单质在氧气中燃烧生成ZO3 | |
| D. | L、Q形成的简单离子核外电子数相等 |
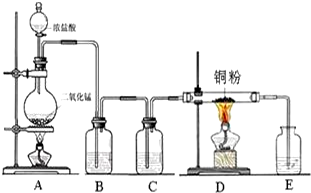 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: 实验室用如图所示装置制取乙烯.
实验室用如图所示装置制取乙烯.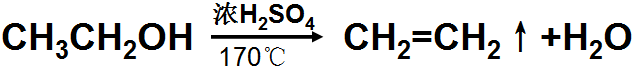
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题: