题目内容
18.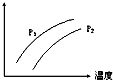 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )| A. | 混合物中L的百分含量 | B. | 混合气体的密度 | ||
| C. | L的转化率 | D. | 混合气体的平均分子量 |
分析 由图可知,压强越大,Y的值的越小,温度越高,Y的值越大,而反应为气体体积增大的吸热反应,根据外界条件对平衡移动的影响答题.
解答 解:由图可知,压强越大,Y的值的越小,温度越高,Y的值越大,而反应为气体体积增大的吸热反应,则
A、压强增大,平衡逆向移动,L的百分含量增大,故A错误;
B、反应中密闭容器中,气体质量守恒,所以密度始终不变,故B错误;
C、压强增大,平衡逆向移动,L的转化率减小,升高温度平衡正向移动L的转化率增大,故C正确;
D、该反应气体质量守恒,压强增大,平衡逆向移动,总物质的量减小,平均相对分子质量增大,温度升高,平衡正向移动,总物质的量增大,平均相对分子质量减小,故D错误;
故选C.
点评 本题主要考查了外界条件对平衡移动的影响,中等难度,解题时注意图与反应的特征相结合.

练习册系列答案
相关题目
6.下列有关溶液的叙述正确的是( )
| A. | 0.1mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-可以大量共存 | |
| B. | 0.1mol•L-1氨水:K+、Na+、NO3-、AlO2-可以大量共存 | |
| C. | 向(CH3COO)2Ba溶液中加入硫酸发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| D. | 已知K${\;}_{{a}_{1}}$(H2CO3)>Ka(HClO)>K${\;}_{{a}_{2}}$(H2CO3),向NaClO溶液中通入少量的CO2,发生反应的离子方程式为:CO2+2ClO-+H2O═CO32-+2HClO |
3.将铁棒和锌棒用导线连接插入CuSO4溶液里,当电池中有0.2mol电子通过时,负极质量的变化是( )
| A. | 增加6.5g | B. | 减少6.5g | C. | 减少5.6g | D. | 增加6.4g |
10.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | N2的电子式: | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
7.下列化合物中不含离子键的是( )
| A. | (NH4)2S | B. | Al2(SO4)3 | C. | CsOH | D. | HNO3 |
 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯. .试回答:
.试回答: +2Na→
+2Na→ +H2↑.
+H2↑.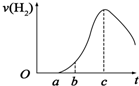 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题: