题目内容
2.下表为元素周期表的一部分,请参照下列元素在表中的位置,用化学用语回答下列问题:
(1)上述元素的最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式),其中含有的化学键类型是:离子键、共价键,c元素10电子的氢化物的电子式为
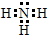 .
.(2)写出e2d2的电子式为
 ,
,(3)写出f的最高价氧化物与e的最高价氧化物的水化物之间的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)由a单质和d的常见单质组成的燃料电池,其电解质溶液为KOH溶液,则正极反应式为:O2+2H2O+4e-=4OH-,工作一段时间后,电解质溶液的PH会变小(选填变大、变小、不变),若该电池每消耗2.24La单质(标准状况)时,转移的电子数为0.2NA.
(5)d的氢化物与i的氢化物的沸点较高的是H2O(填化学式),原因是水分子间存在氢键.
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为AB.
A.MnO2B.FeCl3C.Na2SO3D.K2SO4
(7)已知由a、b形成的一种化合物,其相对分子质量在30~50之间,且b的质量分数为$\frac{6}{7}$.该化合物的分子式为C3H6.
分析 由元素在周期表中位置,可知a为H,b为C、c为N、d为O、e为Na、f为Al、g为Si、h为P、i为S、j为Cl、k为Cl.
(1)元素的金属性越强,其对应最高价氧化物的水化物碱性越强,氢氧化钠为离子化合物,含有O-H极性共价键,氨气中存在三对N-H共价键;
(2)Na2O2是离子化合物,由Na+离子和O2-离子构成;
(3)氢氧化铝为两性氢氧化物,与强碱反应;
(4)KOH溶液为电解液的氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,结合电极反应解答该题;
(5)由于O与H易形成氢键,故水的沸点在同族氢化物中最高;
(6)双氧水在催化剂二氧化锰和氯化铁的催化下容易分解为水和氧气;
(7)由C和H形成的化合物为烃,据此解答即可.
解答 解:由于金属性Na最强,那么NaOH的碱性最强,氢氧化钠中存在钠离子和氢氧根离子,即存在共价键和离子键,NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为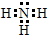 ,故答案为:NaOH;离子键、共价键;
,故答案为:NaOH;离子键、共价键; ;
;
(2)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
(3)难溶物和氧化物不能拆,氢氧化铝与氢氧化钠反应的离子反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)通入氧气的电极为正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,电解质溶液中溶质不变,溶剂的量增大,所以氢氧化钾的物质的量浓度变小,溶液的pH减小,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据化合价可知转移电子0.2mol,故答案为:O2+2H2O+4e-=4OH-;变小;0.2NA;
(6)双氧水容易分解为氧气和水,常利用的催化剂是二氧化锰和氯化铁,故选AB;
(7)a为H元素,b为C元素,形成的化合物中C的质量分数为$\frac{6}{7}$,且其相对分子质量在30~50之间,设化学式为CxHy,则$\left\{\begin{array}{l}{12x+y>30}\\{12x+y<50}\\{\frac{12x}{12x+y}=\frac{6}{7}}\end{array}\right.$,解x=3,y=6,故二者形成的分子式为C3H6,故答案为:C3H6.
点评 本题考查元素周期表与元素周期律、无机物推断、常用化学用语等,难度中等,注意对元素周期律的理解掌握.

| A. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性Ca(HCO3)2的缘故 | |
| B. | 长期盛放NaOH溶液的试剂瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成负压的缘故 | |
| C. | 严格地讲,实验室使用”通风橱”防污染是不负责任的,因为实验产生的有害气体没有得到转化或吸收 | |
| D. | “雨后彩虹”与“海市蜃楼”都是自然界的光学现象,也与胶体知识有关 |
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: 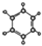 |
(1)A的名称为乙烯,A在一定条件下生成高分子化合物的反应方程式
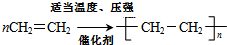 .
.(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一
大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开
始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水
反应使之褪色、⑥任何条件下不与氢气反应.
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
. | A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
| A. | 放电时,LiMn2O4发生氧化反应,电池内部Li+向正极移动 | |
| B. | 放电时,正极反应为:Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 醋酸可用作锂离子电池的电解质 | |
| D. | 充电时,锂的碳材料为阳极且反应为:Li++e-═Li |
| A. | 正极反应:O2+4e-+2H2O=4OH- | |
| B. | 负极反应:2C4H10+26CO32--52e-=34CO2+10H2O | |
| C. | 为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定,故须在通入的空气中加入CO2 | |
| D. | 电解质熔液中的CO32-从正极迁移到负极,而内电路中的电流流向则从负极迁移到正极 |
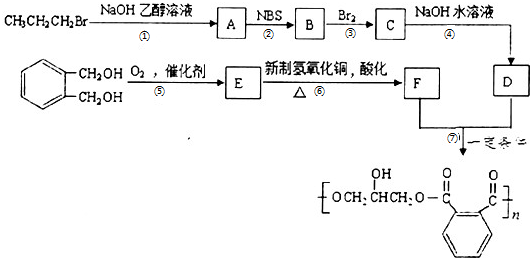
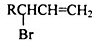
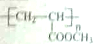 ,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.