题目内容
3.将铁棒和锌棒用导线连接插入CuSO4溶液里,当电池中有0.2mol电子通过时,负极质量的变化是( )| A. | 增加6.5g | B. | 减少6.5g | C. | 减少5.6g | D. | 增加6.4g |
分析 将铁棒和锌棒用导线连接插入硫酸铜溶液中,形成原电池,负极上是金属锌失电子,正极是铜离子得电子,根据电极反应式以及电子转移的计算来回答.
解答 解:将铜和锌用导线连接插入硫酸铜溶液中,形成原电池,负极上是金属锌失电子,设负极上质量减少x.
负极上的电极反应式为:
Zn-2e-=Zn2+,
65g 2mol
x 0.2mol
x=$\frac{65g×0.2mol}{2mol}$=6.5g,所以负极质量减少6.5g.
故选B.
点评 本题以原电池原理为载体考查了物质的量的有关计算,难度不大,明确正负极上发生的反应是解本题的关键,然后根据金属质量和转移电子之间的关系计算即可.

练习册系列答案
相关题目
10.生活中金属的使用已成为一种日常,在生活中使用的金属中,除少量极不活泼金属外几乎所有的金属都以化合态存在,那么我们的问题来了,请问下列各种冶炼方法中,可制得相应金属的是( )
| A. | 加热氧化银 | B. | 煅烧碳酸钙 | ||
| C. | 电解氯化钠溶液 | D. | 氯化镁与铝粉高温共热 |
11.分子式为C7H8,且分子中含有苯环的烃的一氯代物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
18.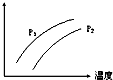 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )| A. | 混合物中L的百分含量 | B. | 混合气体的密度 | ||
| C. | L的转化率 | D. | 混合气体的平均分子量 |
15.城市生活垃圾需实行分类投放,其中废塑料、废橡胶制品都属于( )
| A. | 无机物 | B. | 有机物 | C. | 盐类 | D. | 糖类 |
12.下列实验操作或对实验事实的叙述正确的是( )
| A. | 用瓷坩埚高温熔融NaOH | |
| B. | 用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质 | |
| C. | 碳酸钠的溶解性比碳酸氢钠大 | |
| D. | 检验Fe2+用KSCN溶液 |
13.下表中对离子方程式的评价不合理的是
( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通往少量的SO2: ClO-+H2O+SO2=Cl-+SO42-+2H+ | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸: 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入少量NaOH溶液 NH4++OH-=NH3•H2O | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | 正确 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
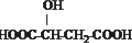
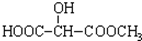 B.
B. C.H3COOC-COOCH3
C.H3COOC-COOCH3 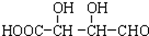 E.
E.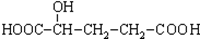
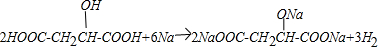 .
.