17.过渡元素在生活、生产和科技等方面有广泛的用途.现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.
下列说法中错误的是 ( )
下列说法中错误的是 ( )
| A. | PFS中铁显+3价 | |||||||||||||||
| B. | 铁原子的价电子排布式是3d74s1 | |||||||||||||||
| C. | 由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 | |||||||||||||||
| D. | 由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| |||||||||||||||
14.下列说法正确的是( )
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 硫酸氢钠属于盐类,其水溶液显中性 |
12.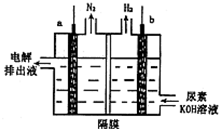 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A. | 电解时,b极是阴极放出H2,发生氧化反应 | |
| B. | 溶液中OH-逐渐向b极移动 | |
| C. | 电解时,a极的电极反应式为:CO(NH2)2+8OH--6e═CO32-+N2↑+6H2O |
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
8. 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
0 168940 168948 168954 168958 168964 168966 168970 168976 168978 168984 168990 168994 168996 169000 169006 169008 169014 169018 169020 169024 169026 169030 169032 169034 169035 169036 169038 169039 169040 169042 169044 169048 169050 169054 169056 169060 169066 169068 169074 169078 169080 169084 169090 169096 169098 169104 169108 169110 169116 169120 169126 169134 203614
 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )| A. | 甲池中电解质溶液的pH值减小 | |
| B. | 乙池中CuSO4溶液的浓度不变 | |
| C. | 甲池中理论上消耗空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| D. | 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O═CO32-+8H+ |
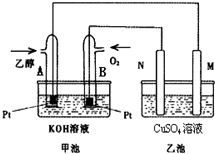 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.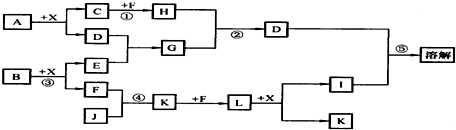
 ,
,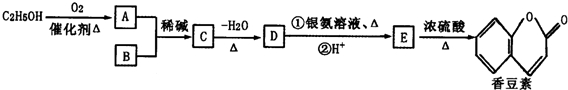
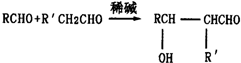 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)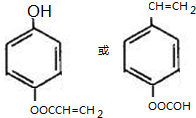 .
.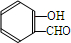 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 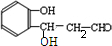 .
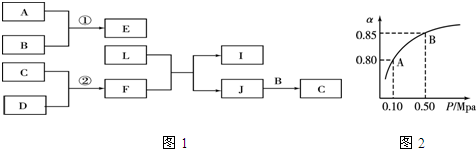
.
 ;J的结构式
;J的结构式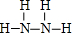 .
.