题目内容
9.A、B、C、D是短周期元素组成的非金属单质,其中B、C、D在常温常压下是气体.其转化关系如图1(有关反应的条件及生成的H2O已略去).E是形成酸雨的污染物之一,F是常见的四原子10电子分子,化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.化合物J是由两种元素组成的18电子分子,分子中原子个数比为1:2,其相对分子质量为32,常温下为液体.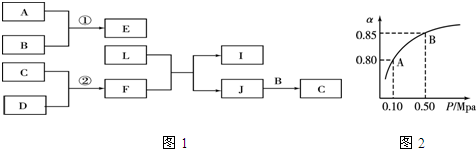
请按要求填空:
(1)写出L的电子式
 ;J的结构式
;J的结构式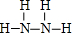 .
.(2)写出F与L反应的离子方程式ClO-+2NH3═N2H4+Cl-+H2O.
(3)取一定量J在B中完全燃烧生成14g C,恢复至101kPa、25℃,放出QkJ热量.则J和B反应的热化学方程式为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-624 kJ/mol.
(4)写出将E通入L的碱性溶液中的离子方程式ClO-+SO2+2OH-═Cl-+SO42-+H2O.
(5)J-空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30% KOH溶液.该燃料电池的负极反应式为N2H4+4OH--4e-═4H2O+N2↑.
(6)对于反应2E+B?2G
①某温度下,E的平衡转化率(α)与体系总压强(P)的关系如图2所示.平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
②有两只密闭容器甲和乙,甲容器有一个可移动的活塞,能使容器内保持恒压,乙容器能保持恒容.起始时分别向两容器内充入2molG气体,在相同的温度和压强下发生反应并达到平衡.下列叙述正确的是C
A.平均反应速率:甲>乙 B.平衡时B的物质的量:甲<乙
C.平衡时G的转化率:甲>乙 D.平衡时G的体积分数:甲>乙.
分析 A、B、C、D都是短周期非金属单质,其中B、C、D在常温常压下是气体,化合物E是形成酸雨的污染物之一,则E为SO2;由反应①可推知A为S,B为O2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO;F是常见的四原子10电子分子,F应为NH3;氨气与NaClO反应生成J,J由两种元素组成的18电子分子,分子中原子个数比为1:2,其相对分子质量为32,常温下为液体,则J为N2H4;J与氧气反应生成C,则C为氮气,由反应②可知D为H2,据此解答.
解答 解:A、B、C、D都是短周期非金属单质,其中B、C、D在常温常压下是气体,化合物E是形成酸雨的污染物之一,则E为SO2;由反应①可推知A为S,B为O2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO;F是常见的四原子10电子分子,F应为NH3;氨气与NaClO反应生成J,J由两种元素组成的18电子分子,分子中原子个数比为1:2,其相对分子质量为32,常温下为液体,则J为N2H4;J与氧气反应生成C,则C为氮气,由反应②可知D为H2.
(1)由上述分析可知,L为NaClO,其电子式为 ,J为N2H4,结构式为
,J为N2H4,结构式为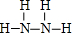 ,故答案为:
,故答案为: ;
;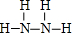 ;
;
(2)F与L反应是氨气与NaClO反应生成为N2H4、NaCl与H2O,反应离子方程式为:ClO-+2NH3═N2H4+Cl-+H2O,
故答案为:ClO-+2NH3═N2H4+Cl-+H2O;
(3)N2H4在O2中完全燃烧生成14gN2,完全燃烧恢复至101kPa、25℃,放出312kJ热量,同时应生成水,14g N2的物质的量=$\frac{14g}{28g/mol}$=0.5mol,则1mol N2H4完全燃烧方程式的热量为624kJ,故该反应的热化学方程式为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-624 kJ/mol,
故答案为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-624 kJ/mol;
(4)将SO2通入NaClO的碱性溶液,ClO-将SO2氧化为SO42-,自身被还原为Cl-,反应的离子方程式为ClO-+SO2+2OH-═Cl-+SO42-+H2O,
故答案为:ClO-+SO2+2OH-═Cl-+SO42-+H2O;
(5)N2H4-空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30% KOH溶液,总反应为生成氮气与水,故负极为N2H4失去电子,碱性条件下生成氮气与水,该燃料电池的负极反应式为N2H4+4OH--4e-═4H2O+N2↑,
故答案为:N2H4+4OH--4e-═4H2O+N2↑;
(6)①平衡常数只与温度有关系,A、B两点温度不变,所以A、B两点的平衡常数相等,故答案为:=;
②发生反应:2SO2+O2?2SO3,有两只密闭容器甲和乙,甲容器有一个可移动的活塞,能使容器内保持恒压,乙容器能保持恒容.起始时分别向两容器内充入2molSO3气体,在相同的温度和压强下发生反应并达到平衡,逆反应为气体物质的量增大的反应,乙中压强增大,故乙的压强较甲中压强大,
A.压强越高反应速率越快,故平均反应速率:乙>甲,故A错误;
B.乙到达的平衡等效为在甲的平衡的基础增大压强,相对甲而言,增大压强平衡向正反应方向移动,故平衡时O2的物质的量:甲>乙,故B错误;
C.由B中分析可知,平衡时乙中参加反应的三氧化硫相对较少,故平衡时SO3的转化率:甲>乙,故C正确;
D.由B中分析可知,平衡时SO3的体积分数:甲<乙,故D错误,
故选:C.
点评 本题与无机物推断、电子式、热化学方程式、原电池、平衡常数、等效平衡等,题目综合性较大,推断物质是解题的关键,难度中等.

| A. | 使用的NaOH固体在空气中敞口放置了一段时间 | |
| B. | 容量瓶用蒸馏水洗净后,未经干燥 | |
| C. | 在烧杯中溶解NaOH后,未经冷却即将溶液转入容量瓶 | |
| D. | 调节天平零点时未将游码回到最左边 |
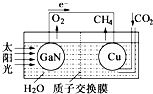 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.以下说法错误的是( )
| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 硫酸氢钠属于盐类,其水溶液显中性 |
| A. | 用Zn粒与稀HCl反应制H2 | B. | 用大理石与稀HCl反应制CO2 | ||
| C. | 用Cu与稀HNO3反应制NO | D. | 用MnO2与浓HCl反应制Cl2 |