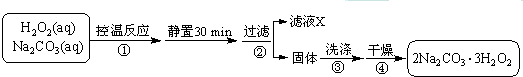
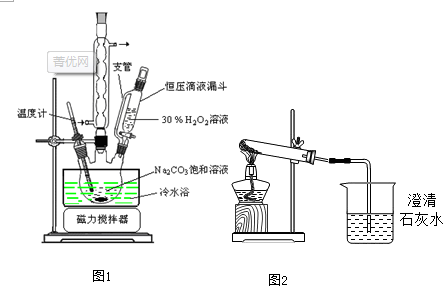
题目内容
12.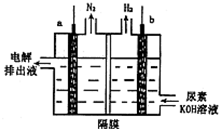 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A. | 电解时,b极是阴极放出H2,发生氧化反应 | |
| B. | 溶液中OH-逐渐向b极移动 | |
| C. | 电解时,a极的电极反应式为:CO(NH2)2+8OH--6e═CO32-+N2↑+6H2O |
分析 由图可知:该电池反应时中电解时总的化学方程式为:CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$CO32-+N2↑+3H2↑,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,生成氢气的电极是阴极,结合电解质溶液中氢氧根离子浓度的变化分析解答.
解答 解:A.该电池反应时中,氢元素被还原,生成氢气的电极b是阴极,故A错误;
B.电解时,电解质溶液中阴离子向阳极移动,根据A知,a是阳极,所以氢氧根离子向a极移动,故B错误;
C.阴a极是阳极发生氧化反应,电极反应式为CO(NH2)2+8OH--6e═CO32-+N2↑+6H2O,故C正确;
故选:C.
点评 本题考查了电解原理,明确元素化合价变化是解本题关键,根据元素化合价变化与阴阳极的关系来分析解答,难度中等.

练习册系列答案
相关题目
20.下列有关晶体的说法错误的是( )
| A. | 金刚石的网状结构中,以共价键形成的最小碳环上有6个碳原子 | |
| B. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| C. | 氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个 | |
| D. | 石墨晶体中,每一层内碳原子数与碳碳键数之比为2:3 |
20.某固体混合物可能含有Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2、NaCl中的一种或几种,现对该混合物做如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积):下列说法不正确的是( )

| A. | 混合物中一定不存在FeCl2和NaCl | |
| B. | 反应④的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ | |
| C. | 混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3 | |
| D. | 白色沉淀5.80g是Mg(OH)2 |
7.下列叙述正确的是( )
| A. | 凡是含有离子键的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 非金属原子间以共价键结合的物质都是共价化合物 |
17.过渡元素在生活、生产和科技等方面有广泛的用途.现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.
下列说法中错误的是 ( )
下列说法中错误的是 ( )
| A. | PFS中铁显+3价 | |||||||||||||||
| B. | 铁原子的价电子排布式是3d74s1 | |||||||||||||||
| C. | 由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 | |||||||||||||||
| D. | 由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| |||||||||||||||
4.下列实验中,能达到预期目的是( )
| A. | 用过滤法除去Fe(OH)3胶体中的FeCl3 | |
| B. | 用25mL碱式滴定管量取20.10mLNa2CO3溶液 | |
| C. | 将SO2通入酸性KMnO4溶液中,可证明SO2具有漂白性 | |
| D. | 欲鉴别AlC13溶液和AgNO3溶液,向2种待测液中分别滴加足量氨水 |
2.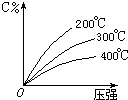 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 化学方程式中n>e+f | |
| C. | 达平衡后,若升温,平衡右移 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |