题目内容
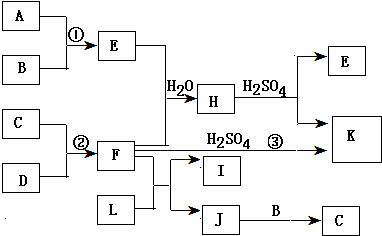
15.四种短周期元素aA、bB、cC、dD,已知原子序数大小关系是:a<c<b<d,且a+b=(c+d)/2;四种元素在周期表中的位置关系是:A、B同主族,C、D也同主族.(1)B、C、D三元素形成的六原子核的化合物和水反应的离子方程式是:SO32-+H2O?HSO3-+OH-.
(2)A、C形成的四原子核化合物甲,该化合物呈弱酸性,试写出这种化合物的电离方程式:H2O2?HO2-+H+.
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:H++HSO3-═SO2↑+H2O.
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液相互反应的化学方程式:H2O2+H2SO3═H2SO4+H2O.
分析 因为四种元素是短周期元素,由A、B同主族,C、D也同主族,且原子序数a<b、c<d,可知C、D肯定是第二、第三周期元素,a+b=(c+d)/2≤$\frac{9+17}{2}$=13,推出A肯定是H元素,由于原子序数b>c,则B元素肯定为Na元素,则有1+11=$\frac{c+c+8}{2}$,解得:c=8,则C为O元素,D为S元素,据此进行解答.
解答 解:因为六种元素是短周期元素,由A、B同主族,C、D也同主族,且原子序数a<b,c<d,可知C、D肯定是第二、第三周期元素,a+b=(c+d)/2≤$\frac{9+17}{2}$=13,A只能是H元素,由于原子序数b>c,则B元素为Na元素,则:1+11=$\frac{c+c+8}{2}$,解得:c=8,则C为O元素、D为S元素,
(1)Na、O、S三种元素形成的六原子核的化合物为Na2SO3,与水反应的离子方程式是:SO32-+H2O?HSO3-+OH-,
故答案为:SO32-+H2O?HSO3-+OH-;
(2)H、O形成的四原子核化合物甲为H2O2,该化合物呈弱酸性,其电离方程式为:H2O2?HO2-+H+,
故答案为:H2O2?HO2-+H+;
(3)由H、Na、O、S四种元素所形成的两种化合物是亚硫酸氢钠与硫酸氢钠,相互反应的离子方程式为:H++HSO3-═SO2↑+H2O,
故答案为:H++HSO3-═SO2↑+H2O;
(4)H、O、S形成的六原子核化合物乙为H2SO3,H2SO3水溶液和过氧化氢水溶液反应生成硫酸与水,反应的化学方程式为:H2O2+H2SO3═H2SO4+H2O,
故答案为:H2O2+H2SO3═H2SO4+H2O.
点评 本题考查原子结构和元素性质,为高考高频点,题目难度中等,侧重考查学生分析推断能力,正确推断元素是解本题关键,熟练掌握元素周期表结构及原子结构.

| A. | 硝基苯和溴苯 | B. | 乙酸乙酯和乙醇 | C. | 苯和四氯化碳 | D. | 环己烷和乙醛 |
| A. | 异丁烷 | B. | 2-甲基丁烷 | C. | 丙烷 | D. | 3-乙基戊烷 |
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
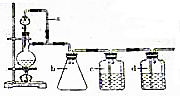 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
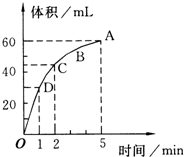 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题: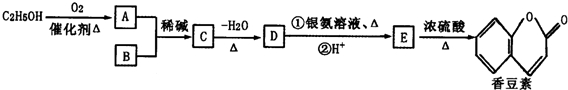
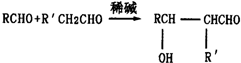 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)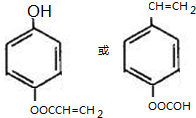 .
.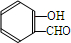 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 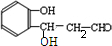 .
.