题目内容
8. 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )| A. | 甲池中电解质溶液的pH值减小 | |
| B. | 乙池中CuSO4溶液的浓度不变 | |
| C. | 甲池中理论上消耗空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| D. | 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O═CO32-+8H+ |
分析 A.甲池能自发的发生氧化还原反应,符合原电池的条件,属于燃料原电池,总的电极反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,导致氢氧根离子的浓度减小;
B.粗铜比铜活泼的金属放电,而阴极一直是铜离子放电,所以铜离子的浓度减小;
C.串联电路中转移电子相等,根据铜离子得电子数计算消耗空气的体积;
D.甲池中,通入甲醇的电极是负极,碱性条件下,电极反应式中不能产生氢离子.
解答 解:A.甲池能自发的发生氧化还原反应,符合原电池的条件,属于燃料原电池,总的电极反应式为::2CH3OH+3O2+4KOH═2K2CO3+6H2O,导致氢氧根离子的浓度减小,所以pH值减小,故A正确;
B.乙池中,阳极上不仅溶解铜还溶解锌、铁、银等金属,阴极上只有铜析出,所以阳极上溶解的铜小于阴极上析出的铜,则溶液中硫酸铜溶液浓度减小,故B错误;
C.串联电路中转移电子相等,析出3.2g铜转移电子的物质的量=氧气得电子的物质的量,所以如果在标况下消耗空气体积=$\frac{\frac{3.2g}{64g/mol}×2}{4}$=2.8L,而状况不知,故C错误;
D.甲池中,通入甲醇的电极是负极,碱性条件下,电极反应式中不能产生氢离子,电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,故D错误;
故选A.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应式是解本题关键,易错选项是D,只有酸碱性条件下,燃料电池中电极反应式不同,所以书写燃料电池的电极反应式要结合电解质溶液的酸碱性,为易错点.

练习册系列答案
相关题目
16.下列有关叙述正确的是( )
| A. | 用饱和食盐水和浓硫酸共热制备HCl气体 | |
| B. | 将H2和Cl2混合,在光照条件下反应,用于工业制备盐酸 | |
| C. | 将Cl2通入饱和石灰水,用于工业生产漂白粉 | |
| D. | 实验室用稀NaOH溶液吸收实验过程中多余的Cl2 |
17.在标准状况下,1L丙烷和2L乙烷的混合气体在80L空气中完全燃烧,生成的气体经干燥后,其体积为( )
| A. | 85L | B. | 75L | C. | 73L | D. | 70L |
16.下列说法错误的是( )
| A. | 利用以下实验器材(规格和数量不限):烧杯、玻璃棒、胶头滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的实验 | |
| B. | 制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 | |
| C. | 向两支盛有KI3溶液的试管中分别加入淀粉和硝酸银溶液,前者溶液变蓝后者产生黄色沉淀,由此得出KI3溶液中存在平衡I3-?I2+I- | |
| D. | 科学家在研究物质微观结构的过程中先后使用了光学显微镜、电子显微镜、扫描隧道显微镜等观测仪器 |
20.只用水不能鉴别的一组物质是( )
| A. | 硝基苯和溴苯 | B. | 乙酸乙酯和乙醇 | C. | 苯和四氯化碳 | D. | 环己烷和乙醛 |
18.用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是( )
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 用酚酞作指示剂时,滴至溶液从红色变成无色即视为滴定终点 | |
| D. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
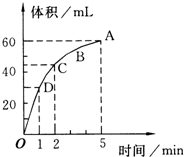 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
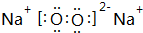 ,
,