题目内容
13.已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性.反应生成的水均已略去.它们有如图所示的关系.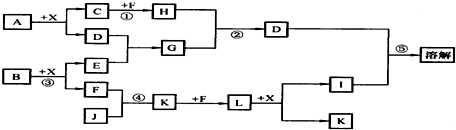
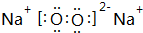
(1)写出化学式:A.Al4C3,C.CH4.B的电子式.
 ,
,(2)反应③中每生成lmolF,转移电子的数目为:1.204×1024.
(3)反应④的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)写出离子方程式分别为:H足量时反应②AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;反应⑤Al(OH)3+3H+=Al3++3H2O.
(5)反应①中,每1.00g C与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ•mol-1.
分析 A、B均是由两种短周期元素组成的化合物,X为无色液体,D具有两性,且A与X反应得到D与C,C为气态氢化物,应是A发生水解反应,可推知X为H2O、D为Al(OH)3,由元素守恒可知A中含有Al元素.D能溶解在I中,I为强酸或强碱,B与水反应得到F,气态氢化物J与F反应得到K,K与F反应得到L,L与水反应得到I与K,中学中工业制备硝酸符合转化关系,可推知J为NH3,F为O2,K为NO,L为NO2,I为HNO3,则B为Na2O2,则E为NaOH、G为NaAlO2.C、J是同周期元素的气态氢化物,即C为第二周期氢化物,与氧气反应生成H,H与偏铝酸钠反应得到Al(OH)3,可推知H为CO2,C为CH4,故A中还含有C元素,则A为Al4C3,其中Al元素质量分数为75%,符合题意,据此解答.
解答 解:A、B均是由两种短周期元素组成的化合物,X为无色液体,D具有两性,且A与X反应得到D与C,C为气态氢化物,应是A发生水解反应,可推知X为H2O、D为Al(OH)3,由元素守恒可知A中含有Al元素.D能溶解在I中,I为强酸或强碱,B与水反应得到F,气态氢化物J与F反应得到K,K与F反应得到L,L与水反应得到I与K,中学中工业制备硝酸符合转化关系,可推知J为NH3,F为O2,K为NO,L为NO2,I为HNO3,则B为Na2O2,则E为NaOH、G为NaAlO2.C、J是同周期元素的气态氢化物,即C为第二周期氢化物,与氧气反应生成H,H与偏铝酸钠反应得到Al(OH)3,可推知H为CO2,C为CH4,故A中还含有C元素,则A为Al4C3,其中Al元素质量分数为75%,符合题意.
(1)由上述分析可知,A为Al4C3,C为CH4,B为Na2O2,电子式为 ,
,
故答案为:Al4C3;CH4; ;
;
(2)反应③为2Na2O2+2H2O=4NaOH+O2,反应中Na2O2起氧化剂、还原剂作用,氧元素化合价从-1价变化为0价,-2价,反应中每生成lmolF(O2)转移电子物质的量为1mol×2=2mol,转移电子数为2mol×6.02×1023mol-1=1.204×1024,
故答案为:1.204×1024;
(3)反应④是氨气的催化氧化反应,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)反应②中足量的二氧化碳气体通入偏铝酸钠溶液中发生的反应,反应的离子方程式为:AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;
反应⑤是氢氧化铝在硝酸中溶解的反应,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;
(5)反应①是甲烷燃烧生成二氧化碳和水的反应,每1.00g CH4与足量的F(O2)作用,恢复到25℃水为液体,放出55.6kJ热量,则1mol甲烷燃烧放热为55.6kJ×$\frac{1mol×16g/mol}{1.00g}$=889.6KJ,故反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ•mol-1.
点评 本题考查无机物推断,基本属于猜测验证型推断,注意以“X为无色液体,D具有两性”为突破口,结合转化关系中连续反应进行推断,需要学生熟练掌握元素化合物知识与中学常见化学工业,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$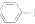
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
在50ml圆底烧瓶中加入无水苯胺5ml.,冰醋酸7.5mL,锌粉0.lg,按下图安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80nun,当反应基本完成时,停止加热.
在搅拌下,趁热将烧瓶中的物料倒人盛有l00mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.将粗品重结晶,抽滤,晾干,称重,计算产率,
注:D为刺形分馏柱,用于沸点差别不太大的混合物的分离.
 ,
,请回答下列问题:
(1)仪器A的名称冷凝管,
(2)装置图中加热可用油浴(填“水浴”或“油浴”).
(3)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(4)为何要控制分馏柱上端的温度在105℃左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(5)通过观察到温度计温度下降或锥形瓶内液体不再增加,现象可判断反应基本完成,反应结束后须立即倒入事先准备好的冰水中的原因乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出.
(6)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(7)该实验最终得到纯品1.8g,则乙酰苯胺的产率是24%.
| A. | 将10 mL0.1 mol•L-1Na2CO3溶液逐滴滴加到10 mlL0.1 mol•L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | 物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 | |
| C. | 向0.1mol•L-1的FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液不褪色,说明FeCl3只有氧化性,无法被氧化剂氧化 | |
| D. | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3浓溶液,可观察到大量淡黄色沉淀与少量白色沉淀,说明Ksp(AgCl)>Ksp(AgBr) |
 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )| A. | 甲池中电解质溶液的pH值减小 | |
| B. | 乙池中CuSO4溶液的浓度不变 | |
| C. | 甲池中理论上消耗空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| D. | 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O═CO32-+8H+ |
| A. | ④①②③ | B. | ④③②① | C. | ④①③② | D. | ②③①④ |
| A. | 若mXa+与nYb-符合题目要求,则m+a=n-b | |
| B. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定小于HnY | |
| C. | X,Y一定不是相邻周期元素 | |
| D. | 若X,Y处于同一周期且X离子所带电荷多于Y离子,则离子半径一定为:X>Y |
| A. | 0.75mol硫酸 | B. | 0.75盐酸 | C. | 0.5mol硝酸 | D. | 0.75mol醋酸 |
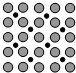 ①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.