题目内容
17.过渡元素在生活、生产和科技等方面有广泛的用途.现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中错误的是 ( )
| A. | PFS中铁显+3价 | |||||||||||||||
| B. | 铁原子的价电子排布式是3d74s1 | |||||||||||||||
| C. | 由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 | |||||||||||||||
| D. | 由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| |||||||||||||||
分析 A.根据正负化合价的代数和为0计算铁元素的化合价,铁元素的两种阳离子,亚铁离子在空气中不能稳定存在,而铁离子在空气中能稳定存在;
B.根据构造原理写出其价层电子排布式;
C.根据物质化合价、状态判断;
D.电离能越大,其失电子越难.
解答 解:A.[Fe2(OH)n(SO4)3-n/2]m中n小于5,且$\frac{n}{2}$为正整数,根据化合物中各元素的化合价代数和为0,铁的化合价为正整数,所以n=2,铁元素的化合价为+3,因为亚铁离子在空气中不稳定,絮状物在空气之中能稳定存在进一步说明为铁离子,故铁的化合价为+3价,故A正确;
B.铁的核外电子排布式为1s22s22p63s23p63d64s2,铁元素的价电子数8,且4s轨道排2个电子,3d轨道排6个电子,所以铁原子的价电子排布式是3d64s2,故B错误;
C.硫酸亚铁中铁元素的化合价是+2价,[Fe2(OH)n(SO4)3-n/2]m中铁元素的化合价是+3价,铁离子水解生成氢氧化铁,所以由FeSO4溶液制PFS需经过氧化、水解和聚合的过程,故C正确;
D.电离能越大,其失电子越难,所以气态Fe2+再失去一个电子比气态Mn2+再失去一个电子容易,故D错误;
故选BD.
点评 本题考查:[Fe2(OH)n(SO4)3-n/2]m的有关知识,难点是铁化合价的判断、注意结合题干信息解答,注意基础知识的积累和运用,题目难度不大.

练习册系列答案
相关题目
8.某小组利用如图装置,用苯与溴在FeBr3催化作用下制备溴苯:

反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按 如下流程分离产品:

已知:
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)“水洗”主要目的是除去FeBr3,“NaOH溶液洗”主要目的是除去Br2.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子是Br-、H+,请设计实验方案验证你的推测.(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)

反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按 如下流程分离产品:

已知:
| 沸点℃ | 密度g/cm3 | 溶解性 | |
| 溴 | 59 | 3.119 | 水中溶解度小,易溶于有机溶剂 |
| 苯 | 80 | 0.8765 | 难溶于水,与有机溶剂互溶 |
| 溴苯 | 156 | 1.50 | 难溶于水,与有机溶剂互溶 |
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)“水洗”主要目的是除去FeBr3,“NaOH溶液洗”主要目的是除去Br2.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子是Br-、H+,请设计实验方案验证你的推测.(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | 将锥形瓶中液体转入分液漏斗,加入适量四氯化碳,振荡后分液.分别取少量上层无色溶液于试管A、B中 | ||
| 2 | 锥形瓶中液体含大量 Br- | ||
| 3 | 锥形瓶中液体含大量 H+ |
5.可以鉴别乙醇、苯酚、硝酸银、纯碱、氢硫酸五种物质的一种试剂是( )
| A. | 稀盐酸 | B. | 溴水 | C. | 酸性高锰酸钾 | D. | 氯化铁溶液 |
12.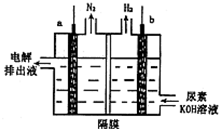 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A. | 电解时,b极是阴极放出H2,发生氧化反应 | |
| B. | 溶液中OH-逐渐向b极移动 | |
| C. | 电解时,a极的电极反应式为:CO(NH2)2+8OH--6e═CO32-+N2↑+6H2O |
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 15g甲基(-CH3)所含的电子数为9NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 标准状况下,22.4LCH4气体与足量Cl2反应可生成NA个CH3Cl分子 | |
| D. | 80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
6.青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为:Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A. | 青石棉可能是一种硅酸盐 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉能和18molHNO3反应 | |
| D. | 青石棉的化学组成可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O |
7.下列各组物质中,所含分子数相同的是( )
| A. | 10g O2和10gH2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.5molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
