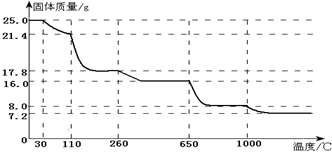
题目内容
16. 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
B、CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol
(1)可见,CH3OH的燃烧热大于(填“大于”、“等于”或“小于”)192.9kJ/mol
(2)已知水的气化热为44kJ/mol,则氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol.如图是某笔记本电脑用一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL3.00mol/L的CuSO4溶液.
请回答下列问题:
(3)甲池中发生反应的化学方程式为C2H5OH+3O2+4KOH=2K2CO3+5H2O;
(4)在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入
0.1mol乙醇.
分析 (1)根据燃烧热的概念来判断;
(2)根据盖斯定律来写热化学方程式;
(3)甲池是燃料电池中,通氧气的极是正极,该极上发生氧气得电子的还原反应,所以总反应方程式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O;
(4)根据乙池中两电极的电极反应计算两电极产生的气体体积恰好相等时转移的电子数,进而确定消耗乙醇的量.
解答 解:(1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,而H2O的稳定化合物是液态水,H2O蒸汽转变为液态水需要放热,所以CH3OH的燃烧热大于192.9kJ/mol,故答案为:大于;
(2)CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol ①
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol ②
②-①得 3H2(g)+3/2O2(g)=3H2O(g)△H=-241.9kJ/mol ③
H2O(l)=H2O(g)△H=+44kJ/mol ④
③-④×3 得 3H2(g)+3/2O2(g)=3H2O(g)△H=-373.9kJ/mol 即H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol;
(3)甲池是燃料电池中,通氧气的极是正极,该极上发生氧气得电子的还原反应,所以总反应方程式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O,故答案为:C2H5OH+3O2+4KOH=2K2CO3+5H2O;
(4)乙池中阳极反应是4OH--4e-═O2↑+2H2O,阴极反应依次是:Cu2++2e-═Cu,2H++2e-═H2,
当铜离子全部放电时,转移电子是0.6mol,
设转移nmol电子时,两极上产生气体的体积相等,
则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),
解得n=1.2,
根据反应C2H6O+3O2═2CO2+3H2O,在转移12mol电子时,消耗C2H6O的量为1mol,当转移1.2mol电子时,理论上消耗乙醇0.1moL,
故答案为:0.1.
点评 本题是一道关于电化学和热化学知识的综合考查题,要求学生注意知识的灵活应用,难度不大.

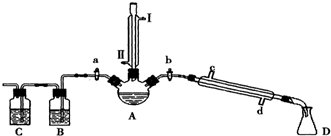
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.
竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);竖直冷凝管的主要作用是冷凝回流.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液.
B装置检验的物质是溴化氢,写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3.
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g1-溴丁烷,则1-溴丁烷的产率是0.70.(答案用小数表示,保留2位小数)
| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
| A. | 用Zn粒与稀HCl反应制H2 | B. | 用大理石与稀HCl反应制CO2 | ||
| C. | 用Cu与稀HNO3反应制NO | D. | 用MnO2与浓HCl反应制Cl2 |
| A. | 久置的氯水中已没有分子,只有离子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
| A. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| B. | 蒸发到析出晶体时才需要用玻璃棒搅拌 | |
| C. | 待溶液蒸干后即停止加热 | |
| D. | 当蒸发皿中出现较多晶体时就应停止加热 |