11.今有五种有机物:
①CH2OH(CHOH)4CHO
②CH3(CH2)3OH
③CH2═CH-CH2OH
④CH2═CH-COOCH3
⑤CH2═CH-COOH.
其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是( )
①CH2OH(CHOH)4CHO
②CH3(CH2)3OH
③CH2═CH-CH2OH
④CH2═CH-COOCH3
⑤CH2═CH-COOH.
其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是( )
| A. | ③⑤ | B. | ①②⑤ | C. | ②④ | D. | ③④ |
9.某反应方程式为 ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 反应物的分子式为C10H10O4 | |
| B. | X的结构简式为CH3OH | |
| C. | 生成物中带“※”号的C原子来自“ ”中的甲基 ”中的甲基 | |
| D. | 反应物和生成物具有相同的不饱和度 |
8.下列说法正确的是( )
| A. | 酸和醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | 实验证实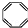 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为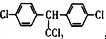 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. | 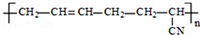 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
7.下列叙述及评价均合理的是( )
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218 O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有. |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性. |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀. |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液. |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物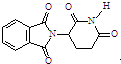 在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(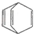 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |
5.下列实验能够成功的是( )
| A. | 用重结晶的方法分离苯甲酸和氯化钠的混合物 | |
| B. | 用苯和溴水在Fe催化下可制得溴苯 | |
| C. | 用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯 | |
| D. | 将电石与水反应后的气体直接通入到溴水中,可以验证乙炔能使溴水褪色的性质 |
4.化学与社会、生产、生活紧切相关.下列说法正确的是( )
0 168901 168909 168915 168919 168925 168927 168931 168937 168939 168945 168951 168955 168957 168961 168967 168969 168975 168979 168981 168985 168987 168991 168993 168995 168996 168997 168999 169000 169001 169003 169005 169009 169011 169015 169017 169021 169027 169029 169035 169039 169041 169045 169051 169057 169059 169065 169069 169071 169077 169081 169087 169095 203614
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| D. | 制作快餐盒的聚苯乙烯塑料是易降解塑料 |
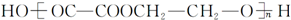 的合成路线如下:[括号内为反应类型,□内为目标产物]
的合成路线如下:[括号内为反应类型,□内为目标产物]
 的化学反应方程式nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$
的化学反应方程式nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O.
+(2n-1)H2O.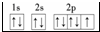 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.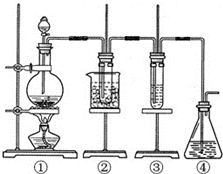 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中: