题目内容
8.下列说法正确的是( )| A. | 酸和醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | 实验证实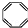 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为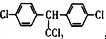 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. | 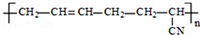 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
分析 A、无机酸能与醇发生非酯化反应;
B、根据CCl4是有机溶剂,会与 互溶,不可能是因萃取而使溶液褪色来分析;
互溶,不可能是因萃取而使溶液褪色来分析;
C、根据苯环中间的C采取sp3杂化来分析;
D、根据高聚物来判断单体时,高聚物中的碳碳双键可能是由三键形成,也可能是由二烯烃形成.
解答 解:A、乙醇能够与氢溴酸发生反应:C2H5OH+HBr→C2H5Br+H2O,生成的溴乙烷为卤代烃,不是酯类,故A错误;
B、由于CCl4是有机溶剂,会与 互溶,故不可能是因萃取而使溶液褪色,故
互溶,故不可能是因萃取而使溶液褪色,故 可使Br2的CCl4溶液褪色是发生了加成反应,则说明该分子中存在独立的碳碳单键和碳碳双键,故B正确;
可使Br2的CCl4溶液褪色是发生了加成反应,则说明该分子中存在独立的碳碳单键和碳碳双键,故B正确;
C、苯环中间的C采取sp3杂化,因此最多两个苯环中的12和碳原子和连接两个苯环的碳原子即一共有13个碳原子共面,故C错误;
D、该高聚物链节主链不含杂原子,属于加聚反应生成的高聚物,链节主链上存在碳碳双键结构,有6个碳原子,其单体必为两种,按如图所示断开 ,在将双键中的1个C-C打开,然后将半键闭合即可的该高聚物单体为:CH2=CH-CH=CH2、CH2=CH-CN,故D错误.
,在将双键中的1个C-C打开,然后将半键闭合即可的该高聚物单体为:CH2=CH-CH=CH2、CH2=CH-CN,故D错误.
故选B.
点评 本题考查了加聚反应原理及高分子化合物单体的求算,题目难度中等,注意掌握加聚反应的概念及反应原理,明确高分子化合物单体的求算方法.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
19.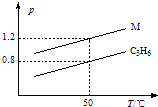 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )| A. | SO2 | B. | CO2 | C. | C3H8 | D. | CO和N2 |
16.现有下列几组粒子:①N2、CO;②NH4+、OH-;③O22-、CN-;④PO43-、ClO4-.对上述四组粒子归类正确的是( )
| A. | 质子数相等、电子数和原子数不相等:① | |
| B. | 质子数和电子数相等、原子数不相等:② | |
| C. | 电子数相等、质子数和原子数不相等:③ | |
| D. | 原子数和电子数相等、质子数不相等:④ |
13.下列有关化学用语使用正确的是( )
| A. | NH3分子的结构式: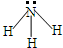 | |
| B. | NH4Cl的电子式: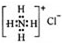 | |
| C. | 原子核内有10个中子的氧原子:818O | |
| D. | Cl-离子的结构示意图: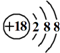 |
18.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式 .
.
(2)B基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,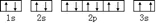 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3.
(6)C和F的第一电离能大小关系为Mg>K(用元素符号表示)
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.(2)B基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3.
(6)C和F的第一电离能大小关系为Mg>K(用元素符号表示)
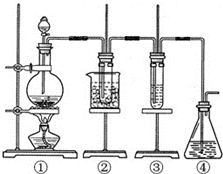 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中: ;
; ;
;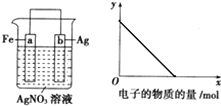 按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )