题目内容
12.某同学设计由G (CH3CH2OH)合成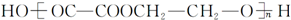 的合成路线如下:[括号内为反应类型,□内为目标产物]
的合成路线如下:[括号内为反应类型,□内为目标产物]
①写出反应类型:a消去反应,b氧化反应;
②写出□内物质的结构简式:ⅠCH2=CH2,ⅡCH2BrCH2Br.
③写出Ⅱ→Ⅲ的化学反应方程式CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr
④Ⅲ与Ⅵ反应合成
 的化学反应方程式nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$
的化学反应方程式nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O.
+(2n-1)H2O.
分析 根据G(CH3CH2OH)经过系列反应得到 可知,G发生消去反应生成Ⅰ,则Ⅰ为:CH2=CH2;Ⅰ与溴水反应生成Ⅱ,则Ⅱ为:CH2BrCH2Br;Ⅱ发生取代反应生成的Ⅲ能够催化氧化生成
可知,G发生消去反应生成Ⅰ,则Ⅰ为:CH2=CH2;Ⅰ与溴水反应生成Ⅱ,则Ⅱ为:CH2BrCH2Br;Ⅱ发生取代反应生成的Ⅲ能够催化氧化生成 ,则Ⅲ为乙二醇:HOCH2CH2OH;根据产物
,则Ⅲ为乙二醇:HOCH2CH2OH;根据产物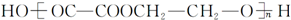 可知Ⅳ为HOOC-COOH,该反应方程式为:nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$
可知Ⅳ为HOOC-COOH,该反应方程式为:nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O,据此进行解答.
+(2n-1)H2O,据此进行解答.
解答 解:根据G(CH3CH2OH)经过系列反应得到 可知,G发生消去反应生成Ⅰ,则Ⅰ为:CH2=CH2;Ⅰ与溴水反应生成Ⅱ,则Ⅱ为:CH2BrCH2Br;Ⅱ发生取代反应生成的Ⅲ能够催化氧化生成
可知,G发生消去反应生成Ⅰ,则Ⅰ为:CH2=CH2;Ⅰ与溴水反应生成Ⅱ,则Ⅱ为:CH2BrCH2Br;Ⅱ发生取代反应生成的Ⅲ能够催化氧化生成 ,则Ⅲ为乙二醇:HOCH2CH2OH;根据产物
,则Ⅲ为乙二醇:HOCH2CH2OH;根据产物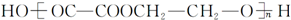 可知Ⅳ为HOOC-COOH,该反应方程式为:nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$
可知Ⅳ为HOOC-COOH,该反应方程式为:nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O,
+(2n-1)H2O,
①根据分析可知,a为乙醇发生消去反应生成乙烯,该反应为消去反应;b为乙二醛催化氧化生成乙二酸,该反应为氧化反应,
故答案为:消去反应;氧化反应;
②Ⅰ的结构简式为:CH2=CH2;Ⅰ与溴水反应生成Ⅱ,则Ⅱ为:CH2BrCH2Br,
故答案为:CH2=CH2;CH2BrCH2Br;
③Ⅱ为CH2BrCH2Br,Ⅲ为乙二醇(HOCH2CH2OH),1,2-二溴乙烷发生取代反应生成乙二醇的方程式为:CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$ +2NaBr,
+2NaBr,
故答案为:CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr;
④发生缩聚反应生成乙二酸乙二酯和水,反应方程式为:nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:nHOCH2CH2OH+nHOOC-COOH$→_{△}^{浓硫酸}$ +(2n-1)H2O.
+(2n-1)H2O.
点评 本题考查有机推断,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,涉及有机物推断、有机反应方程式书写、有机反应类型判断等知识,试题培养了学生的分析能力及灵活应用基础知识的能力.

2Na2S(aq)+Na2CO3(aq)+4SO2(aq)═3Na2S2O3(aq)+CO2(g)△H>0
实验小组在实验室用硫化碱法制备Na2S2O3.5SH2O流程如下:
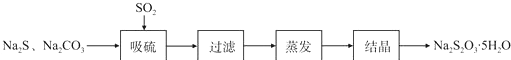
(1)吸硫装置如图所示.
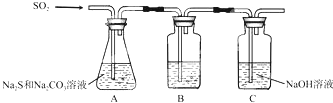
①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气
②为了提高SO2的吸收率,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外可采用合理的措施是
增大SO2的接触面积、控制SO2的流速、适当升高温度等(写出两条)
③假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验
已知:室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀硝酸、AgNO3溶液、BaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
已知:IO3+5I+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-.
| A. | 有机化合物都是从有机体中提炼出来的 | |
| B. | 有机物和无机物的性质完全不同 | |
| C. | 所有有机物均含有碳元素 | |
| D. | 所有有机物均含有氢元素 |
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218 O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有. |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性. |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀. |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液. |
| A. | A | B. | B | C. | C | D. | D |
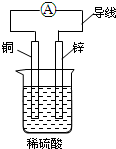
| A. | 锌片为负极,铜片为正极 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 铜片发生的反应为Cu-2e-═Cu2+ | |
| D. | 电流方向是由锌片通过导线流向铜片 |
| A. | 甲酸 | B. | 乙酸 | C. | 硫酸 | D. | 乙醇 |

据此判断下列说法中正确的是( )
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,等质量S(g)和S(s)的能量比较,S(s)能量较高 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 |


 .
. 按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸.
按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸. .试剂c最好选用C(填字母序号).
.试剂c最好选用C(填字母序号). .
. 和一个
和一个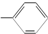 ,则该有机物可能的结构有(不考虑立体异构)( )
,则该有机物可能的结构有(不考虑立体异构)( )