题目内容
9.某反应方程式为 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 反应物的分子式为C10H10O4 | |
| B. | X的结构简式为CH3OH | |
| C. | 生成物中带“※”号的C原子来自“ ”中的甲基 ”中的甲基 | |
| D. | 反应物和生成物具有相同的不饱和度 |
分析 A.由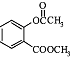 可知分子式;
可知分子式;
B.由质量守恒定律可知X的分子式;
C.由反应可知,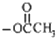 中甲基上的H被取代;
中甲基上的H被取代;
D.苯环不饱和度为3,双键不饱和度为1,环状结构的不饱和度为1.
解答 解:A.由 可知分子式为C10H10O4,故A正确;
可知分子式为C10H10O4,故A正确;
B.由质量守恒定律可知X的分子中含1个C、4个H、1个O,则X的结构简式为CH3OH,故B正确;
C.由反应可知,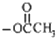 中甲基上的H被取代,则生成物中带“※”号的C原子来自“
中甲基上的H被取代,则生成物中带“※”号的C原子来自“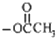 ”中的甲基,故C正确;
”中的甲基,故C正确;
D.苯环不饱和度为3,双键不饱和度为1,则反应物的不饱和度为5,而生成物中不饱和为6,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意守恒法应用及取代反应的分析,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
20.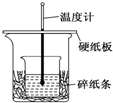 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
17.下列离子方程式书写正确的是( )
| A. | Fe2(SO4)3和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2 SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
4.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| D. | 制作快餐盒的聚苯乙烯塑料是易降解塑料 |
14.下列元素中,原子半径最小的是( )
| A. | Li | B. | Na | C. | F | D. | Cl |
18.有一种MCFC型氢氧燃料电池,电解质为熔融的K2CO3.电池的总反应为:2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2.下列说法中正确的( )
| A. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池放电时,电池中CO32-的物质的量将逐渐减少 | |
| D. | 电路中电子由负极、经熔融的K2CO3流到正极,形成闭合回路 |
19.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题.
(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.

(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能 (kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.