3.有机物CH3CH2C(CH3)2CH(C2H5)CH3的准确命名是( )
| A. | 3,4-二甲基-4-己基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,4,4-三甲基己烷 | D. | 2,3,3-三甲基己烷 |
20.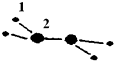 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: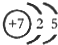 .
.
(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:从平衡表达式可以看出,当c(NH3•H2O)、c(Mg2+)改变相同的程度,c2(NH3•H2O)对沉淀生成的影响更大[或①中c(Mg2+)•c2(OH-)≥Ksp[Mg(OH)2],而②中c(Mg2+)•c2(OH-)<Ksp[Mg(OH)2].
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v=k[I-]1[ClO-]b[OH-]c(温度一定时,k为常数).
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: .
.(2)已知1.0mol•L-1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低.溶液pH降低的原因是HSO3-+Cl2+H2O=3H++SO42-+2Cl-(用离子方程式表示).
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表.则该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l)?NH3(g)+$\frac{3}{4}$O2(g)△H=+382.5kJ/mol(或2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol).
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
2NH4+(aq)+Mg(OH)2(s)?Mg2+(aq)+2NH3•H2O(aq)
写出上述反应的平衡常数表达式K=$\frac{c(M{g}^{2+})•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$
某研究性学习小组为探究Mg2+与NH3•H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1mol/L氨水和1mol/L MgCl2溶液混合 | 无现象 |
(5)在室温下,化学反应I-(aq)+ClO-(aq)=IO-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I-的初始浓度 (mol•L-1) | ClO-的初始浓度 (mol•L-1) | OH-的初始浓度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
①设计实验2和实验4的目的是探究ClO-对反应速率的影响;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH=13,反应的初始速率v=7.2×10-4.
19.下列说法正确的是( )
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g),△H<O;升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
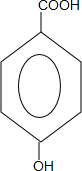
18.以下表示物质通过一步反应的转化关系,下列说法正确的是( )
X$\stackrel{O_{2}}{→}$酸性氧化物→还原性盐.
X$\stackrel{O_{2}}{→}$酸性氧化物→还原性盐.
| A. | X可能是Si单质 | B. | X可能是含S元素的化合物 | ||
| C. | 酸性氧化物可能为CO2 | D. | 还原性盐可能为FeCl3 |
17.下列说法正确的是( )
| A. | 中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 | |
| B. | 常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| C. | 向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 增大 | |
| D. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 |
16.下列说法正确的是( )
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
14.下列叙述正确的是( )
0 168892 168900 168906 168910 168916 168918 168922 168928 168930 168936 168942 168946 168948 168952 168958 168960 168966 168970 168972 168976 168978 168982 168984 168986 168987 168988 168990 168991 168992 168994 168996 169000 169002 169006 169008 169012 169018 169020 169026 169030 169032 169036 169042 169048 169050 169056 169060 169062 169068 169072 169078 169086 203614
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4C1至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
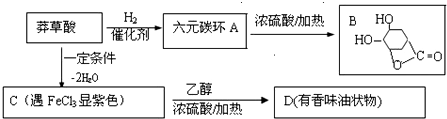
 .
. +CH3CH2OH$→_{△}^{浓硫酸}$H20+
+CH3CH2OH$→_{△}^{浓硫酸}$H20+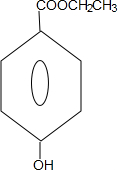 .
. (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取 ;
;