题目内容
17.下列说法正确的是( )| A. | 中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 | |
| B. | 常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| C. | 向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 增大 | |
| D. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 |
分析 A、相同物质的量的因素和醋酸中和NaOH的物质的量相同;
B、常温下,pH=12的Na2CO3溶液中c(OH-)=0.01mol/L;
C、CH3COOH溶液中加入少量CH3COONa固体,醋酸根离子浓度增大,抑制醋酸电离;
D、NH4Cl溶液中铵根离子水解,铵根离子浓度越小,水解程度越大.
解答 解:A、中和等体积、等物质的量浓度盐酸和醋酸溶液消耗NaOH溶液相同,故A错误;
B、pH=12的Na2CO3溶液中c(H+)=10-12mol/L,故溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$=0.01mol/L,溶液中n(OH-)=20L×0.01mol/L=0.2mol,OH-离子数目为0.2mol×NAmol-1=0.2NA,故B正确;
C、醋酸根离子浓度增大,抑制醋酸电离,所以c(H+)减小,c(CH3COOH)增大,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 减小,故C错误;
D、铵根离子浓度越小,其水解程度越大,所以10mL 0.50mol•L-1NH4Cl溶液与比20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量多,故D错误;
故选B.
点评 本题考查了酸碱中和反应时与酸性强弱无关、离子物质的量的计算、影响弱酸电离平衡移动的因素、盐类水解,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.相关化学用语表示正确的是( )
| A. | NH4Br的电子式: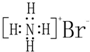 | |
| B. | S原子的结构示意图: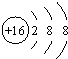 | |
| C. | 次氯酸的电子式: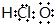 | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
8.分类是化学研究中常用的方法.下列分类方法中,不正确的是( )
| A. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| B. | 根据相对分子质量的大小将共价化合物分为小分子化合物和高分子化合物 | |
| C. | 根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
5.下列各说法正确的是( )
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=QKJ/mol(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ | |
| B. | 热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 小苏打在水中的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
12.下列反应的离子方程式正确的是( )
| A. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-十H2O═2HCO3- | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+═Fe2++H2O |

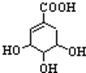 .
. +CH3CH2OH$→_{△}^{浓硫酸}$H20+
+CH3CH2OH$→_{△}^{浓硫酸}$H20+ .
.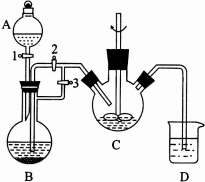 乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.
乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O. ;
;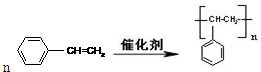 ;
; .
.