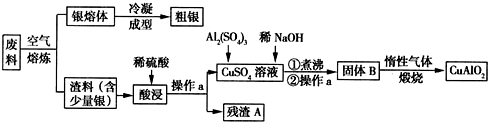
题目内容
1. (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取了sp3 杂化方式,分子的空间构型是三角锥.
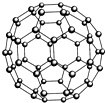
(2)富勒烯(C60)的结构如图,1molC60分子中σ键的数目为90NA.继C60后,科学家又合成了Si60、N60.请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是:结构相似的分子晶体,分子晶体的熔点与其相对分子质量成正比,相对分子质量越大,分子间作用力越强,熔化所需能量越多,所以熔点Si60>N60>C60;而破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多.
(3)氟化氢水溶液中存在氢键有4种.
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家.某准晶体是锰与另一个短周期元素X形成的凝固态.已知:金属的电负性一般小于1.8.元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是Al,锰与X在准晶体中的结合力为金属键.
| 元 素 | X | Y | Z |
| 电 负 性 | 1.5 | 1.2 | 1.8 |
| 第一电离能/kJ•mol-1 | 578 | 738 | 787 |
分析 (1)铬为24号元素,处于第四周期第VIB族,最外层6个电子,据此书写;与铬同周期,最外层有3个未成对电子数的元素是砷,该元素的最低价氢化物是砷化氢,根据价层电子对互斥理论确定砷原子杂化方式及分子的空间构型;
(2)利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目;结构相似的分子晶体熔点与其相对分子质量成正比,破坏分子需要断开化学键,元素的化学键的稳定性与元素的电负性成正比;
(3)氟化氢的水溶液中存在的氢键有:氟化氢分子间、水分子间、氟化氢和水分子间;
(4)根据X的电负性和电离能判断出X为Al元素,与Mn结合在一起的化学键为金属键.
解答 解:(1)铬为24号元素,处于第四周期第VIB族,最外层6个电子,其价电子排布为:3d54s1,与铬同周期,最外层有3个未成对电子数的元素是砷,该元素的最低价氢化物是砷化氢,砷化氢分子中砷原子含有3个共价单键及一个孤电子对,所以其杂化方式为sp3,该分子为三角锥形结构,故答案为:3d54s1;砷;sp3; 三角锥;
(2)每个碳原子含有的σ键个数且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为$\frac{3}{2}$,所以1mol C60分子中σ键的数目=$\frac{3}{2}$NA=90NA,Si60、N60、C60都是结构相似的分子晶体,分子晶体的熔点与其相对分子质量成正比,相对分子质量越大,分子间作用力越强,熔化所需能量越多,所以熔点Si60>N60>C60;破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多,所以破坏分子需要的能量顺序为:N60>C60>Si60,
故答案为:90NA;结构相似的分子晶体,分子晶体的熔点与其相对分子质量成正比,相对分子质量越大,分子间作用力越强,熔化所需能量越多,所以熔点Si60>N60>C60,而破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多;
(3)氟化氢的水溶液中存在的氢键有:氟化氢分子间、水分子间、氟化氢和水分子间有两种,所以一共有4种氢键,故答案为:4;
(4)X第三电离能与第四电离能之间有较大的差距,说明X最外层电子数为3,且电负性小于2,属于金属,可推断为Al元素,Mn是金属,二者以金属键结合,故答案为:Al;金属键.
点评 本题考查了物质结构及性质,涉及知识点较多,同时考查学生空间想象能力中原子的堆积模式,难点是杂化方式的判断,知道价层电子对的计算方法,难度中等.

| A. | 盛放待测液的锥形瓶使用前未用待测液润洗 | |
| B. | 用酚酞作指示剂,配制好的碱溶液在空气中吸收了少量二氧化碳气体 | |
| C. | 锥形瓶中颜色由红色变无色,马上记录终点读数,但半分钟不到,溶液又恢复红色 | |
| D. | 读标准酸液初始体积时俯视,终点时平视读数 |

(1)白色沉淀甲是BaSO4.
(2)试写出实验过程中生成气体A、B的离子方程式CO32-+2H+=H2O+CO2↑、NH+4+OH-=NH3↑+H2O.
(3)通过上述实验,可确定X溶液中一定存在的离子是NH+4、CO32-、SO42-,要确定可能存在的离子,需补加的实验是K+.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
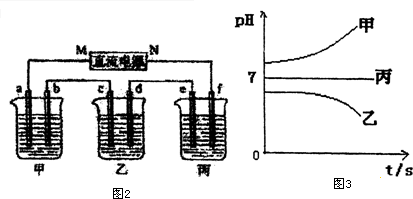
接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图3.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”)电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(2)计算电极e上生成的气体在标准状况下的体积5.6L;
(3)写出乙烧杯的电解池反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是加入4.5g水.
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |