9.为实现下列实验目的,如表提供的主要仪器以及所用试剂均合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 测定中和热 | 烧杯、玻璃棒、纸板、保温塑料、温度计 | 50mL0.5mol/LNaOH溶液与50mL0.5mol/L盐酸 |
| C | 测定生成H2速率 | 分液漏斗、锥形瓶、针筒、铁架台 | Zn粒、稀硫酸 |
| D | 浓硫酸脱水性 | 分液漏斗、试管 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法正确的是( )
| A. | 硅石常用作光导纤维、光学仪器的原料 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | 酚醛树脂可作木材粘合剂、制作食用器具 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
7.已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.请回答下列问题:
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
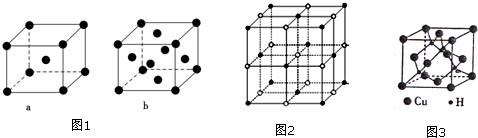
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl.
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).

3.固体X只可能由A1、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验,下列判断正确的是( )
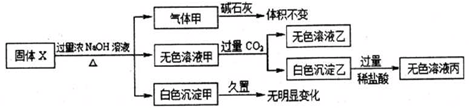

| A. | 气体甲一定是纯净物 | |
| B. | 将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 | |
| C. | 固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 | |
| D. | 白色沉淀甲可能是混合物 |
2.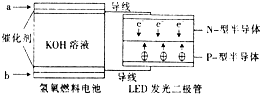 LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
 LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )| A. | a处通入氢气,发生还原反应 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | 该装置中只涉及两种形式的能量转化 | |
| D. | P-型半导体连接的是电池负极 |
1.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸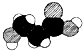 | |
| D. | 化合物 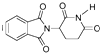 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
20.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E 同主族,B与F 同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
0 168680 168688 168694 168698 168704 168706 168710 168716 168718 168724 168730 168734 168736 168740 168746 168748 168754 168758 168760 168764 168766 168770 168772 168774 168775 168776 168778 168779 168780 168782 168784 168788 168790 168794 168796 168800 168806 168808 168814 168818 168820 168824 168830 168836 168838 168844 168848 168850 168856 168860 168866 168874 203614
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
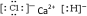 .
. 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.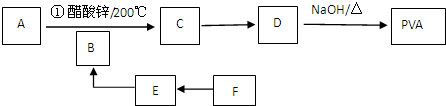
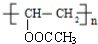 +n NaOH→
+n NaOH→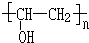 +n CH3COONa.
+n CH3COONa.