题目内容
3.固体X只可能由A1、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验,下列判断正确的是( )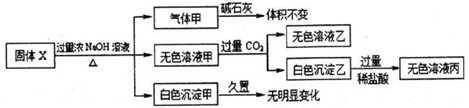
| A. | 气体甲一定是纯净物 | |
| B. | 将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 | |
| C. | 固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 | |
| D. | 白色沉淀甲可能是混合物 |
分析 固体X与过量浓氢氧化钠溶液反应生成气体甲,Al、(NH4)2SO4都能与NaOH反应生成反应,分别生成氢气和氨气,且两种气体通过碱石灰后体积都不会发生变化,则气体甲可能为氢气和氨气的混合物;
生成的无色溶液甲中通入过量二氧化碳后生成无色溶液乙和白色沉淀乙,则白色沉淀为氢氧化铝,原固体X中一定含有AlCl3;生成的白色沉淀甲久置无变化,则固体X中一定不含AgN03、FeCl2,否则氢氧化银(不稳定,很快会转化成棕黑色的氧化银沉淀)、氢氧化亚铁沉淀的颜色会发生变化,一定含有MgCl2,根据以上分析对各选项进行判断.
解答 解:固体X与过量浓NaOH溶液反应生成气体甲,该气体可能为氢气或氨气,因为Al、(NH4)2SO4都能与NaOH反应生成反应,分别生成氢气和氨气,且两种气体通过碱石灰后体积都不会发生变化;
生成的无色溶液甲中通入过量二氧化碳后,生成了无色溶液乙和白色沉淀乙,白色沉淀溶于盐酸,则白色沉淀只能为氢氧化铝,是偏铝酸根离子与二氧化碳反应生成的,所以原固体X中一定含有AlCl3;
固体X与NaOH还生成的白色沉淀甲,沉淀甲久置无变化,则固体X中一定不含AgN03、FeCl2,否则氢氧化银(不稳定,很快会转化成棕黑色的氧化银沉淀)、氢氧化亚铁沉淀的颜色会发生变化,一定含有MgCl2,
A.由以上分析可知,气体甲可能为氢气和氨气的混合物,故A错误;
B.无色溶液乙中含有碳酸氢根离子,无色溶液丙中含有铝离子,二者发生双水解反应生成氢氧化铝沉淀,故B正确;
C.根据分析可知,固体X中一定含有AlCl3、MgCl2,至少含有Al、(NH4)2SO4中的一种,不一定含有(NH4)2SO4,故C错误;
D.白色沉淀甲为氢氧化镁,属于纯净物,故D错误;
故选B.
点评 本题考查物质的检验与鉴别,为高考中的常见题型,属于中等难度的试题,试题综合性强,难度中等,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率;该类试题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,然后进行判断、推理、验证即可.

 名校课堂系列答案
名校课堂系列答案| A. | 用CoCl2溶液浸泡过的棉花制成简易湿度计,悬挂在家中,以粗略估计空气的湿度 | |
| B. | 在1mL0.5mol/L的AlCl3溶液中加入2mL饱和的NaF溶液,再加入1mL3.mol/L的氨水,整个过程都无明显现象 | |
| C. | 向1mL1%的NaOH溶液中加入2ml2%的CuSO4溶液,振荡后再加入0.5mL有机物X,溶液呈现绛蓝色,则X是甘油 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏高 |
| A. | 1.8g重水中含有的电子数为NA | |
| B. | 1L0.1mol/L FeCl3溶液中含有的Cl- 数为0.3NA | |
| C. | 25℃,1L pH=13的Ba(OH)2溶液中含有的oH-数为0.2NA | |
| D. | 标准状况下,2.24L NO和NO2混合气体中含有的氧原子数为0.15NA |
| A. | 氢氧燃料电池要进入广泛的实际应用,高容量储氢材料的研制是需解决的关键技术问题之一 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 2013年6月航天员王亚平在太空做的水膜实验说明:水分子的组成和结构在太空中发生了改变,水才有不同于其在地球上的物理现象 | |
| D. | 元素分析仪可检验C、H、O、N、S等非金属元素,也可以检验Cr、Mn等金属元素 |
| A. | 硅石常用作光导纤维、光学仪器的原料 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | 酚醛树脂可作木材粘合剂、制作食用器具 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
| A. | C7H15OH | B. | C6H13OH | C. | C5H12OH | D. | C2H5OH |
| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加水稀释的过程中c(OH-)不断增大 | |
| D. | 向含有Na2SO4的BaSO4悬浊液中加水稀释,c(Ba2+)增大 |
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
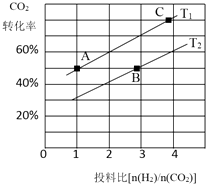 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.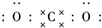 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.